Ventrikulære ekstrasystoler er svært vanlig og vurderes oftest i allmennpraksis og på medisinske avdelinger utenfor de spesialiserte kardiologiske miljøene. Selv om VES i de fleste tilfeller hverken trenger behandling eller har prognostisk betydning, er det nødvendig med en systematisk tilnærming for å gjenkjenne de som skal behandles eller trenger spesialistvurdering.
Stine Aagaard-Nilsen, forskerlinjestudent på Universitet i Oslo, Institutt for eksperimentell medisinsk forskning, Universitetet i Oslo og Oslo universitetssykehus, og kardiologisk avdeling, Oslo universitetssykehus Rikshospitalet
Lars Andreas Dejgaard, legespesialist, PhD, kardiologisk avdeling, Oslo universitetssykehus RikshospitaletOle-Gunnar Anfinsen, overlege, PhD, kardiologisk avdeling, Oslo universitetssykehus Rikshospitalet
Finn Hegbom, overlege, PhD, kardiologisk avdeling, Oslo universitetssykehus Rikshospitalet
Erik Kongsgård, seksjonsoverlege, PhD, kardiologisk avdeling, Oslo universitetssykehus Rikshospitalet
Mathis Korseberg Stokke, professor, overlege, PhD, Institutt for eksperimentell medisinsk forskning, Universitetet i Oslo og Oslo universitetssykehus, og kardiologisk avdeling, Oslo universitetssykehus Rikshospitalet
Ventrikulære ekstrasystoler (VES) er et fenomen mange leger møter i daglig klinisk praksis. Konteksten er imidlertid avgjørende for hvilken oppmerksomhet denne typen arytmi bør få. Vi har inntrykk av at mange er usikre på betydningen av VES i en gitt klinisk sammenheng, og at de ofte avskrives som godartet uten behov for nærmere vurdering. Riktignok er VES oftest et fenomen uten prognostisk betydning for pasienten, men det er viktig å kjenne til unntakene og erkjenne at VES kan gi betydelige plager. For leger som behandler pasienter med VES er det viktig å kjenne til begrensningene ved de behandlingsrådene og medikamentene som benyttes. Kateterablasjon kan være et effektivt behandlingsalternativ, men det kan være utfordrende å skille ut pasientene som egner seg for slik behandling.
VES er elektrisk aktivering av hjertet som starter i ventriklene. Utbredelsen av den elektriske aktiveringen følger ikke ledningssystemet og blir derfor langsommere enn normalt, hvilket gjenspeiles i breddeforøket QRS-kompleks. Begrepet VES forbeholdes elektrisk aktivering som kommer prematurt i forhold til grunnrytmen. Forsinket breddeforøkede QRS-komplekser kaller vi erstatningsslag, og bør føre til vurdering av om pasienten har et bradykardiproblem. VES kan ha de samme mekanismene som ved andre takykardier. Generelt vil takyarytmier skyldes endringer i egenskapene til myokard, og først og fremst kardiomyocyttene. Det kan dreie seg om midlertidige faktorer som elektrolyttforstyrrelser, metabolske avvik, infeksjoner eller iskemi, eller underliggende medfødte, arvelige eller ervervede hjertesykdommer. Alle sykdommer som påvirker hjertet kan endre kardiomyocyttenes evne til å generere elektrisk aktivitet, og muligheten for den elektriske impulsen til å bre seg ut i myokard. Graden av påvirkning og summen av ulike påvirkninger avgjør om VES oppstår.
Hos de fleste pasienter med VES kan vi ikke påvise noen disponerende faktorer. En hypotese for VES hos pasienter uten underliggende hjertesykdom eller andre åpenbare forklaringer er at elektrisk aktivering oppstår i vevsrester fra føtallivet med pacemakeregenskaper. Slikt vev er bl.a. påvist i lungearterien og i utløpet av høyre ventrikkel. Elektrofysiologiske endringer i myokard som følger med økende alder kan kanskje forklare hvorfor elektrisk aktivitet kan gjøre seg gjeldende på ulike tidspunkter i livet. En annen hypotese er at noen VES oppstår som følge av arrvev etter gjennomgått myokarditt. Vi har ikke gode anslag for hvor mange dette kan gjelde.
Det autonome nervesystemet spiller en vesentlig rolle for arytmiutvikling. Samspillet mellom det autonome nervesystemets virkning på hjertet og andre disponerende faktorer påvirker om pasienten får VES ved fysisk aktivitet eller i hvile. Såkalt trigget arytmi oppstår ved økt sympatisk aktivering og økt hjertefrekvens, mens automatismer ikke nødvendigvis har en entydig relasjon til aktiviteten i det autonome nervesystemet. Det hevdes ofte at VES også kan skyldes såkalt sirkelstrøm (reentry-kretser), spesielt i syke hjerter, men vi har ikke god dokumentasjon for dette. Arytmi som skyldes sirkelstrøm vil også være følsomme for sympatisk aktivering.
I et 12-avlednings-EKG med registrering i 10 sekunder vil 1-5 % av befolkningen ha VES (1, 2). Blant hjertefriske voksne vil 40-75 % ha en eller flere VES i en 24-timers EKG-registrering (1, 3). Antall VES per døgn øker med pasientens alder, men vi har ikke gode tall for hva som bør regnes som normalt (4, 5). Epidemiologiske studier har i begrenset grad utelukket personer med faktorer og sykdommer som disponerer for VES. Vi regner imidlertid med at kun 1-4 % vil ha hyppige eller komplekse VES (6), definert som > 60/t eller 1/min (1).
Mange pasienter har VES uten å merke det, eller å oppleve det som plagsomt. Pasienter som oppgir symptomer som kan relateres til VES, plages oftest av palpitasjoner (61%), brystsmerter (33%) og dyspne (22%) (7). Mange beskriver også svimmelhet, og noen få har nærsynkoper. Synkoper er sjeldent hos pasienter med VES, og skal gi mistanke om annen årsak (8), slik som vedvarende takyarytmier eller bradykardi. Pasienter som har svært mange VES opplever ofte økt trettbarhet og generell utmattelse. Symptomene kan lindres i perioder med færre VES.
Vi vet lite om hvilke karakteristika ved VES som påvirker symptombyrden. Det har vært hevdet at hjertets fylning når VES inntreffer vil påvirke slagvolumet (5). Det er imidlertid ikke god dokumentasjon for å trekke en klar sammenheng mellom slike faktorer og symptomer.
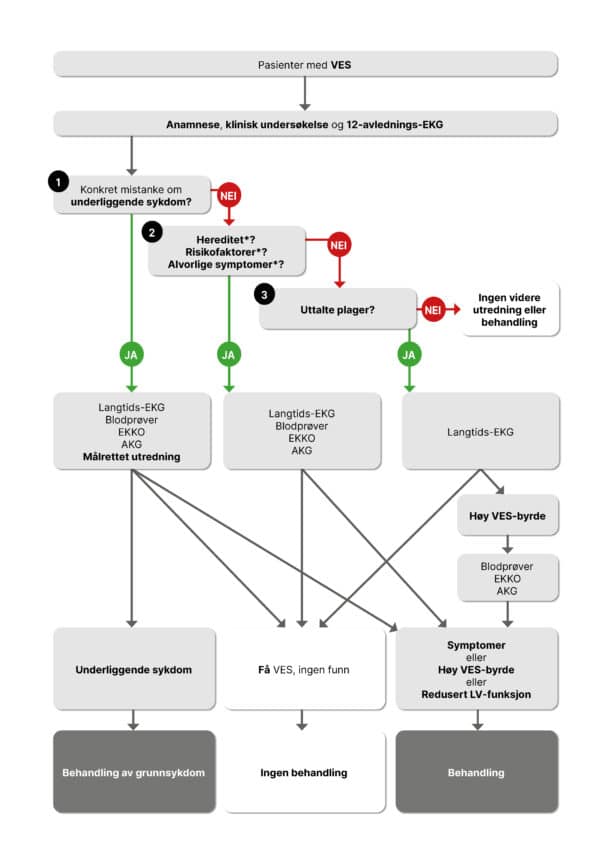
Man kan få mistanke om VES ut fra anamnese og palpasjon av pulsen, men EKG er nødvendig for å stille diagnosen. Påvisning av VES i EKG bør utløse en systematisk vurdering av hvilken betydning det har hos den aktuelle pasienten og i den konkrete situasjonen: Er VES årsaken til pasientens symptomer? Er VES et enkeltstående fenomen eller uttrykk for underliggende hjertesykdom? Man kommer langt med anamnese og klinisk undersøkelse, og ofte i mål med enkle undersøkelser. Hos en del pasienter er det nødvendig med mer spesialiserte undersøkelser og utredning hos kardiolog. I det følgende vil vi løfte fram noen aspekter som hører med i en utredning.
Sykehistorien kan avdekke symptombyrde og tegn til underliggende sykdom. Symptomer er oftest avgjørende for om man bør starte behandling og hvor langt man skal gå for å utelukke annen sykdom. Kjent arvelig hjertesykdom, plutselig død i ung alder hos nære slektninger eller synkope i pasientens egen historie er varseltegn som klinikeren må være oppmerksom på. Man bør også huske at hyppige besvimelser eller epilepsilignende anfall noen ganger kan skyldes arytmisykdom.
EKG med 12 avledninger er avgjørende for vurderingen, fordi det gir informasjon om ev. underliggende hjertesykdom i tillegg til egenskaper ved arytmien. QRS-morfologi ved VES gir en pekepinn på utgangspunktet for arytmien: Grovt sagt gjelder at venstre grenblokkslignende utseende tyder på opphav i høyre ventrikkel, mens høyre grenblokkslignende mønster kommer fra venstre ventrikkel. Inferiør akse med dominerende positive utslag i II, avF og III passer med utgangspunkt superiort/anteriort i ventrikkelen, mens aktivering som starter inferiort gir negative utslag i samme (5). Det hyppigste opphavsstedet for VES uten relasjon til underliggende hjertesykdom, og med godartet prognose, er høyre ventrikkels utløp (RVOT). VES herfra har venstre grenblokkslignende mønster og inferiør akse (Figur 1). Dette forutsetter imidlertid riktig elektrodeplassering, og avhenger av hjertets leie i thorax. For nærmere lokalisasjon finnes algoritmer med varierende grad av treffsikkerhet.
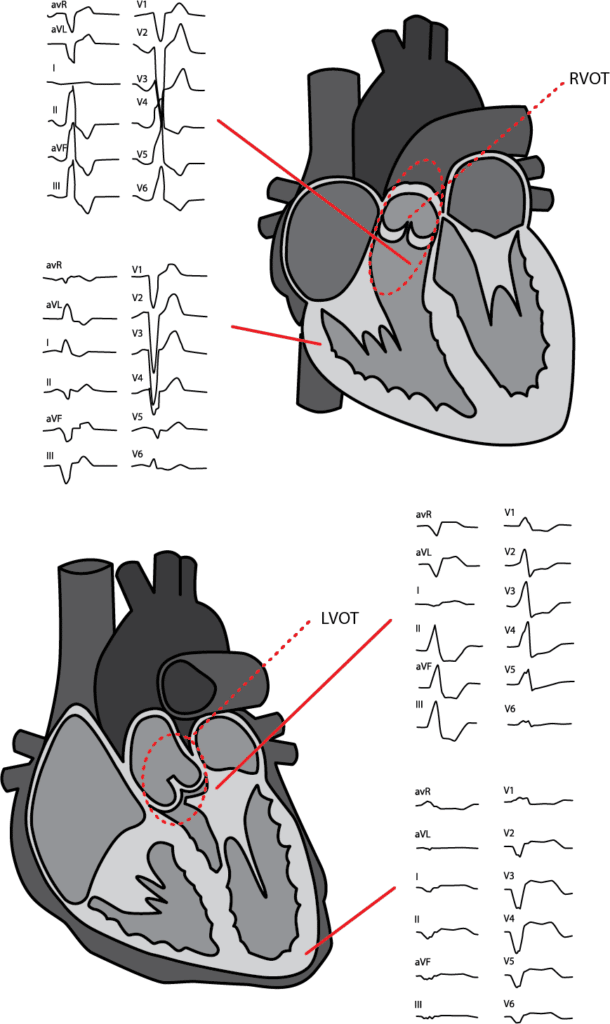
VES i et vanlig EKG gir en indikasjon på hyppigheten i døgnet, men jo lengre opptak man gjør, jo riktigere bilde får man av VES-byrden (9). Fordi variasjonen fra dag til dag er stor, er opptil 7 dagers opptak nødvendig for å få et representativt gjennomsnittsantall (9).
EKG-opptak ved fysisk belastning er viktig i arytmidiagnostikk. Selv om arbeids-EKG i dag har liten plass i diagnostikk av koronarsykdom, er relasjonen mellom belastning og arytmi fortsatt viktig for å skille godartede VES fra alvorlige arytmier som inntreffer ved trening. En innledende orientering krever ikke avansert utstyr: Knebøy eller trappegang kan gi en god indikasjon på hvordan frekvensen av VES endres ved belastning. Økende VES ved trening skal medføre målrettet utredning mtp. koronarsykdom eller annen hjertesykdom, dog ut fra en individuell vurdering av risiko. VES i hvilefasen etter belastning er assosiert med dårligere prognose (10, 11). Dette skyldes trolig underliggende hjertesykdom hos noen av disse pasientene.
Etter EKG i hvile og ved belastning, bør orienterende blodprøver utføres hos alle pasienter mtp. anemi, elektrolyttforstyrrelser og stoffskiftesykdom, samt vurdering av risiko for koronarsykdom. Terskelen bør også være lav for å henvise pasienter til ekkokardiografi hvis man vurderer å starte behandling. I de aller fleste tilfeller vil dette være tilstrekkelig til å avdekke strukturell hjertesykdom som krever behandling. Vi vet imidlertid ikke om eksklusjon av underliggende strukturell hjertesykdom hos denne pasientgruppen fordrer MR-undersøkelse. Eventuelle andre undersøkelser rekvireres ut fra spesifikk mistanke om underliggende sykdom.
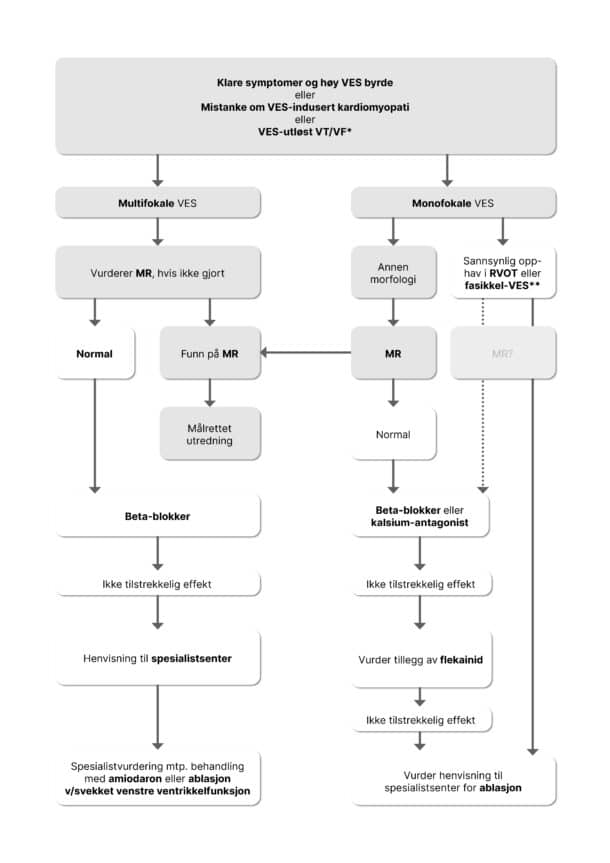
De fleste pasienter med VES trenger ikke behandling. Behandlingsindikasjonen er en kombinasjon av plager og et høyt antall VES. En høy VES-byrde over tid kan føre til hjertesvikt hos noen pasienter. Vi kjenner ikke eksakt hva som er kritisk grense, men mer enn 24 % VES antas å kunne medføre dysfunksjon av venstre ventrikkel i løpet av måneder til år (12). Enkelte studier har imidlertid funnet forbedring av dysfunksjon ved behandling ved en langt lavere grense, helt ned til 5-9 % (13-15). En utfordring for diagnostikk er at redusert venstre ventrikkelfunksjon som følge av andre årsaker, også disponerer for VES. Årsaksforholdet kan dermed være vanskelig å bestemme, men pasienter med hjertesvikt skal uansett behandles etter gjeldende retningslinjer. Pasienter med hjertesvikt som har mange VES som har ett felles utgangspunkt i hjertet, bør imidlertid vurderes for ablasjon, spesielt om etiologien for hjertesvikten er uklar.
Man bør spørre om pasienten selv har registrert noen utløsende faktorer som f.eks. kaffe, røyk, alkohol, søvnmangel eller har symptomer på søvnapné. Hos noen kan slike faktorer påvirke hyppigheten av VES, selv om målrettet intervensjon ikke reduserer plager eller VES-byrde på gruppenivå.
Hvis man velger å begynne med medikamenter, er betablokker ofte førstevalg. Dette skyldes mest tradisjon, ettersom det er få studier som støtter slik behandling framfor andre, og kun et begrenset antall pasienter har tilfredsstillende effekt (16, 17). Kalsiumantagonister kan være effektivt hos noen, men skal ikke brukes ved hjertesvikt. Kombinasjon med flekainid er ofte effektivt, men krever at iskemisk hjertesykdom er utelukket. Amiodaron er et siste alternativ som ofte reduserer antall VES betydelig, men pga. bivirkningsprofilen bør dette bare benyttes hvis alle andre muligheter har feilet, og symptomene er invalidiserende.
En del pasienter bør tilbys kateterablasjon, og antagelig flere enn i dag. Som et grovt utgangspunkt er denne behandlingen forbeholdt pasienter med tydelige symptomer og mer enn 10.000 VES per døgn over tid. Behandlingen med kateterablasjon har god og varig effekt hos langt flere enn medikamentell behandling, men suksessen avhenger av lokalisasjon og at VES kommer fra ett sted i hjertet (18, 19). Kateterablasjon av VES fra høyre utløpstrakt har høyest suksessrate (18). Som all invasiv behandling medfører også kateterablasjon en viss risiko for komplikasjoner, men alvorlige hendelser er svært sjeldent (18).
Alle leger må iblant forholde seg til VES, enten tilfeldig oppdaget i EKG eller som årsak til pasientens plager. Med en systematisk tilnærming med enkle kliniske verktøy kan man vurdere om VES opptrer som et frittstående fenomen hos pasienten eller skyldes underliggende sykdom. VES kan også være et uttrykk for underliggende arytmirelaterte sykdommer, men er svært sjelden årsak til alvorlig arytmi i strukturelt normale hjerter. Behandling rettet mot å redusere VES-byrden er indisert ved uttalte plager eller der man tenker at VES kan bidra til utvikling av hjertesvikt. Når behandling er indisert, er medikamenter førstevalg, men det er vesentlig å kjenne til begrensningene ved medikamentene som brukes i dag. Ablasjonsbehandling er et effektivt alternativ, men som utgangspunktet forbeholdt pasienter med > 10 000 VES per 24 timer over noe tid, eller der man mener VES bidrar til svekket venstre ventrikkelfunksjon eller kan utløse alvorlige arytmier.
1. Ng GA. Treating patients with ventricular ectopic beats. Heart. 2006;92(11):1707-12.
2. Nguyen KT, Vittinghoff E, Dewland TA, et al. Ectopy on a Single 12-Lead ECG, Incident Cardiac Myopathy, and Death in the Community. J Am Heart Assoc. 2017;6(8).
3. Brodsky M, Wu D, Denes P, et al. Arrhythmias documented by 24 hour continuous electrocardiographic monitoring in 50 male medical students without apparent heart disease. Am J Cardiol. 1977;39(3):390-5.
4. Kostis JB, McCrone K, Moreyra AE, et al. Premature ventricular complexes in the absence of identifiable heart disease. Circulation. 1981;63(6):1351-6.
5. Marcus GM. Evaluation and Management of Premature Ventricular Complexes. Circulation. 2020;141(17):1404-18.
6. Kennedy HL, Whitlock JA, Sprague MK, et al. Long-term follow-up of asymptomatic healthy subjects with frequent and complex ventricular ectopy. N Engl J Med. 1985;312(4):193-7.
7. Park KM, Im SI, Lee SH, et al. Left Ventricular Dysfunction in Outpatients with Frequent Ventricular Premature Complexes. Tex Heart Inst J. 2022;49(1).
8. Lee A, Walters TE, Gerstenfeld EP, et al. Frequent Ventricular Ectopy: Implications and Outcomes. Heart Lung Circ. 2019;28(1):178-90.
9. Hsia BC, Greige N, Patel SK, et al. Determining the optimal duration for premature ventricular contraction monitoring. Heart Rhythm. 2020;17(12):2119-25.
10. Frolkis JP, Pothier CE, Blackstone EH, et al. Frequent ventricular ectopy after exercise as a predictor of death. N Engl J Med. 2003;348(9):781-90.
11. Dewey FE, Kapoor JR, Williams RS, et al. Ventricular arrhythmias during clinical treadmill testing and prognosis. Arch Intern Med. 2008;168(2):225-34.
12. Baman TS, Lange DC, Ilg KJ, et al. Relationship between burden of premature ventricular complexes and left ventricular function. Heart Rhythm. 2010;7(7):865-9.
13. Yarlagadda RK, Iwai S, Stein KM, et al. Reversal of cardiomyopathy in patients with repetitive monomorphic ventricular ectopy originating from the right ventricular outflow tract. Circulation. 2005;112(8):1092-7.
14. Lee A, Denman R, Haqqani HM. Ventricular Ectopy in the Context of Left Ventricular Systolic Dysfunction: Risk Factors and Outcomes Following Catheter Ablation. Heart Lung Circ. 2019;28(3):379-88.
15. Sarrazin JF, Labounty T, Kuhne M, et al. Impact of radiofrequency ablation of frequent post-infarction premature ventricular complexes on left ventricular ejection fraction. Heart Rhythm. 2009;6(11):1543-9.
16. Krittayaphong R, Bhuripanyo K, Punlee K, et al. Effect of atenolol on symptomatic ventricular arrhythmia without structural heart disease: a randomized placebo-controlled study. Am Heart J. 2002;144(6):e10.
17. Stec S, Sikorska A, Zaborska B, et al. Benign symptomatic premature ventricular complexes: short- and long-term efficacy of antiarrhythmic drugs and radiofrequency ablation. Kardiol Pol. 2012;70(4):351-8.
18. Wang JS, Shen YG, Yin RP, et al. The safety of catheter ablation for premature ventricular contractions in patients without structural heart disease. BMC Cardiovasc Disord. 2018;18(1):177.
19. Zhong L, Lee YH, Huang XM, et al. Relative efficacy of catheter ablation vs antiarrhythmic drugs in treating premature ventricular contractions: a single-center retrospective study. Heart Rhythm. 2014;11(2):187-93.
20. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. ESC Scientific Document Group. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022 Aug 26:ehac262. Epub ahead of print.