Enteropati med intestinal totteatrofi forårsakes oftest av cøliaki. Ikke-cøliakisk enteropati kan være en diagnostisk utfordring. Dette illustreres med to kasuistikker med medikament-indusert enteropati ved bruk av olmesartan.
Elisabeth Sofie Meisfjord, medisinstudent, Universitetet i Oslo.
Kristin Hammersbøen Bjørlykke, overlege PhD, Gastromedisinsk avdeling, Akershus Universitetssykehus.
Lars Gustav Lyckander, overlege, Avdeling for patologi, Oslo Universitetssykehus, Rikshospitalet.
Håkon Seierstad, overlege, Spesialist i fordøyelsessykdommer og indremedisin, Sykehuset Innlandet Hamar.
Knut E. A. Lundin, utdanningsleder, professor, dr. med. Institutt for klinisk medisin, Det medisinske fakultet, UiO Overlege, Seksjon for gastromedisin,
Avdeling for Transplantasjonsmedisin, KIT, OUS Rikshospitalet.
Det er godt kjent at cøliaki er den vanligste årsaken til enteropati med totteatrofi i tynntarm. Diagnosen cøliaki stilles på bakgrunn av funn på duodenalbiopsier og positive serumprøver (1). I diagnostikken vektlegges også god respons på glutenfri diett. Diagnostikken er ofte enkel – men når noe ikke stemmer, må man tenke på andre årsaker. Ikke-cøliakisk enteropati er en heterogen sykdomsgruppe, som blant annet rommer medikamentindusert enteropati (2). Tilstanden kan bli svært alvorlig for pasientene, men behandlingen er heldigvis effektiv.
NSAIDs og immunsupprimerende medikamenter har lenge vært kjent for å kunne gi mild enteropati. I 2012 ble det for første gang beskrevet en mulig sammenheng mellom angiotensin II-reseptorblokkeren (ARB) olmesartan og alvorlig ikke-cøliakisk enteropati, og flere tilfeller har blitt rapportert siden (3, 4). Virkestoffet olmesartanmedoksomil er et prodrug som omdannes til olmesartan, og brukes på indikasjonene essensiell hypertensjon hos voksne, samt hypertensjon hos barn i alderen 6-18 år. I Felleskatalogen er «sprue-liknende enteropati» oppført som en svært sjelden bivirkning av olmesartanmedoksomil i preparatomtalen (5). Tilstanden kjennetegnes av alvorlig diaré, vekttap og totteatrofi (4).
En internasjonal konsensusartikkel fra 2022 hevdet at medikamentindusert enteropati er enkelt å skille fra såkalt seronegativ cøliaki (2). Vårt inntrykk er at enteropati forårsaket av ARB-er ikke er godt nok kjent i Norge, og vi ønsker derfor å rette oppmerksomheten mot denne alvorlige medikamentbivirkningen ved hjelp av to kasuistikker fra to forskjellige sykehus i Helse Sør-Øst. Begge pasientene har samtykket til publisering og avgitt skriftlig samtykke til oppslag i journal og etterundersøkelse av vevsprøver.
En kvinne i 60-årene ble innlagt på lokalsykehus med magesmerter, løs og hyppig avføring med vond lukt, samt et ufrivillig vekttap på 3-4 kg over de siste månedene.
Av tidligere sykdommer hadde hun diabetes type 1 med retinopati, hypertensjon og claudicatio intermittens. Av faste medisiner brukte hun bumetanid 1 mg x 1, atenolol 50 mg x 1, olmesartanmedoksomil/hydroklortiazid 20 mg/12,5 mg x 2, acetylsalisylsyre 160 mg x 1, simvastatin 20 mg x 1, lerkanidipin 20 mg x 1 og insulin glargin uten angitt dose.
Gjennom et halvt år hadde pasienten flere innleggelser med vedvarende vanntynn diaré og ytterligere vekttap. Iskemisk kolitt ble vurdert etter funn på koloskopi og på bakgrunn av hennes karsykdom. Koloskopi to måneder senere viste normal kolonslimhinne.
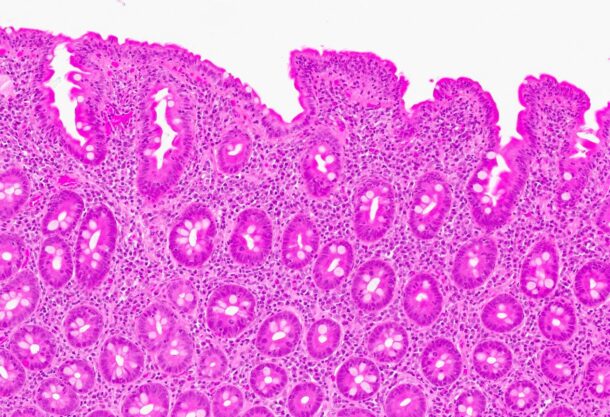
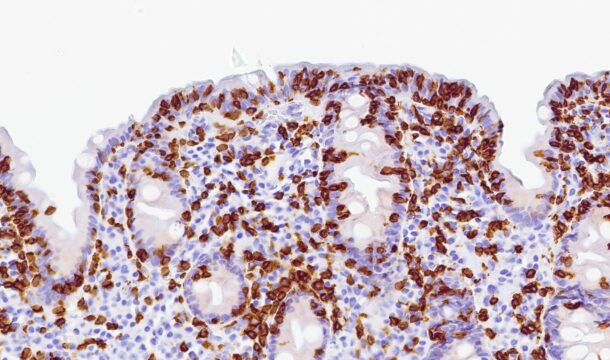
Det ble da også tatt biopsier fra terminale ileum, som viste moderat totteatrofi og kronisk betennelse. Duodenalbiopsi viste totteatrofi og økt antall intraepiteliale lymfocytter (bilde 1 og 2) tilsvarende cøliaki Marsh grad 3b. Anti-TG2 var negativ og hun hadde normal total IgA. MR av tynntarm viste normale forhold.
Etter 4 måneder var det totale vekttapet på 15 kg, og pasienten hadde begynt å miste håret. Til nå hadde hun blitt behandlet med væske intravenøst, loperamid, fordøyelsesenzymer og D-vitamintilskudd i uvanlig store doser, uten at dette resulterte i betydelig bedring.
Differensialdiagnosene som ble drøftet var iskemisk kolitt, cøliaki, autonom nevropati grunnet langvarig diabetes type 1, eksokrin pankreassvikt, Crohns sykdom og tynntarmslymfom. Cøliaki ble sett på som lite sannsynlig basert på negativ serologi og negativ HLA-typing for DQ2 og DQ8. Det ble tatt flowcytometri fra duodenum og benmargsbiopsi med tanke på tynntarmslymfom, uten å finne holdepunkter for malignitet.
To måneder senere ble pasienten vurdert på universitetssykehus. På dette tidspunktet hadde hun ikke lenger diaré og magesmerter, men fremdeles vedvarende lav vekt og hårtap. Enteroskopi var uten funn av forklarende patologi. Biopsi viste igjen en tynntarmslimhinne med totteatrofi og økt antall intraepiteliale lymfocytter, og nå i tillegg krypthyperplasi. PCR for Tropheryma whipplei var negativ.
Medikamentet olmesartanmedoksomil/hydroklortiazid som pasienten hadde vært behandlet med de siste 4 årene, ble så foreslått som mulig årsak til hennes plager. Legemidlet ble seponert.
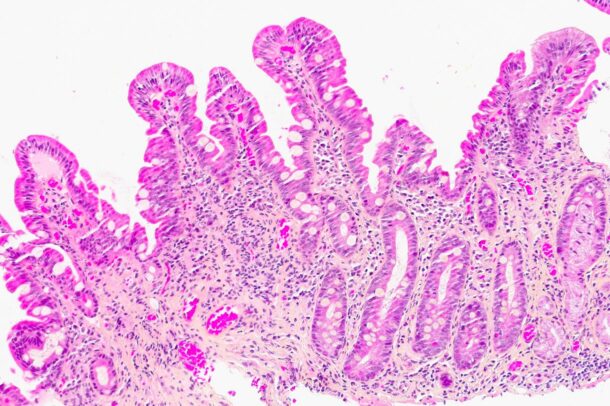
To måneder senere hadde pasienten lagt på seg 5 kg, og hadde mer normalisert avføring. Magesmertene var borte, og håret hadde begynt å komme tilbake. Kontollbiopsi fra duodenum et år senere viste normalisering av slimhinnen med kun mindre områder med ombygget tottearkitektur og gastrisk metaplasi (bilde 3). Vekten var stabil, og hun hadde ingen abdominale plager.
Pasienten beskriver perioden med sykdom som svært alvorlig. Både hun selv og hennes pårørende var redde for at hun ikke skulle klare seg. Hun husker best den forferdelige vonde lukta, konstant løping på toalettet og at hun var veldig sliten. I dag lever pasienten helt uten plager fra mage og tarm. Hun har de siste årene hatt et hjerneslag uten sekveler, og har leddplager i hendene. Ellers føler hun seg i god form.
En mann i slutten av 60-årene ble innlagt på sykehus med vandig diaré de siste tre ukene og et ufrivillig vekttap på 7 kg.
Av tidligere sykdommer hadde han hyperkolesterolemi, hypertensjon og lavgradig cancer prostata under aktiv overvåkning. Av faste medisiner brukte han olmesartanmedoksomil/hydroklortiazid 20 mg/12,5 mg x 1, atorvastatin 40 mg x 1 og allopurinol 100 mg x 1 ved behov.
Gjennom 1,5 år var pasienten innlagt 7 ganger med residiverende og etter hvert refraktær diaré. I denne perioden hadde han et totalt vekttap på 23 kg, tilsvarende 30% av kroppsvekten. Første avføringsprøve i forløpet var positiv for PCR adenovirus. Koloskopi viste en hvitlig forandring på ileocøkalklaffen med usikker betydning. Biopsi fra kolon hadde diffuse funn som ble tolket som regenerative forandringer etter adenovirus. Senere koloskopi inkludert kolonbiopsier viste normale forhold.
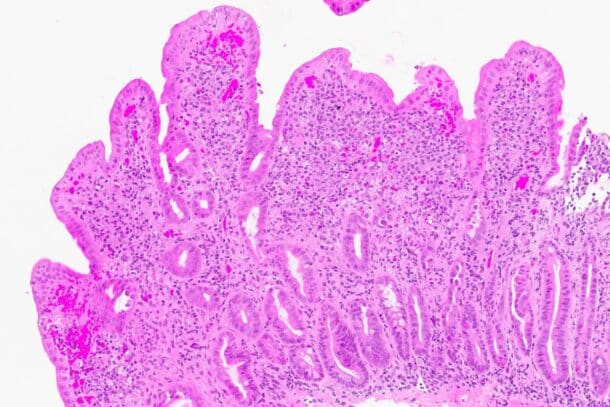
Gastroskopi avdekket en lett gastroduodenitt og en småknudrete duodenalslimhinne. Duodenalbiopsi tidlig i forløpet viste moderat til uttalt totteatrofi, og det ble ikke vist økt antall intraepiteliale lymfocytter (bilde 4 og 5). Duodenalbiopsier senere i forløpet viste totteatrofi og flekkvis økt antall intraepiteliale lymfocytter, tolket som forenlig med cøliaki. Det ble ikke påvist Giardia lamblia eller Tropheryma whipplei. Kapselendoskopi viste atrofiske slimhinner. Serumprøvene for cøliaki var negative, men pasienten var positiv for HLA DQ-2.5. Pasienten forsøkte glutenfri diett, men ble etter hvert svært dårlig og hadde behov for sondeernæring med parenteralt supplement.
Først ble pasienten vurdert til å ha en postinfeksiøs diaré. Siden plagene vedvarte, vurderte man mikroskopisk kolitt eller Crohns sykdom, men man fant ikke holdepunkter for dette histologisk. Autoimmun enteropati ble også vurdert på bakgrunn av duodenalfunn, men pasienten testet negativt for antistoffer mot tarmepitelceller. CT tynntarm viste mulig mesenteriell adenitt. Manglende funn av monoklonale, maligne celler avkreftet mistanken om refraktær cøliaki type 2. Refraktær cøliaki type 1 ble arbeidsdiagnosen, men det var klart at det var «noe som ikke stemte».
Pasienten ble periodevis behandlet med budesonid, prednisolon og infliksimab med variabel effekt. Han ble også behandlet med loperamid og opiumsdråper samt fordøyelsesenzymer grunnet mistanke om sekundær pankreasinsuffisiens.
Olmesartanindusert enteropati kom etter hvert opp som en mulig diagnose, og olmesartanmedoksomil/hydroklortiazid ble seponert. Pasienten hadde vært behandlet med legemidlet i 3 år.
3 måneder senere var pasienten i betydelig bedring med totalt 16 kg vektoppgang og fast regelmessig avføring. Han tok tilskudd med kaliumsitrat, magnesium, kalsium og vitamin D. Biopsi fra tynntarm viste tarmtotter med reaktive forandringer med regenerasjon og lett redusert høyde, senere retolket som tilnærmet normalt (bilde 6). Man så ingen intraepiteliale lymfocytter, men økt antall plasmaceller i lamina propria, som ved uspesifikk duodenitt. Ved ny kontroll 6 måneder senere hadde pasienten fremdeles regelmessig, normal avføring, tok ingen tilskudd, og hadde gått opp ytterligere 13 kg.
Pasienten husker perioden med sykdom som dramatisk. Han var helt sengeliggende mot slutten, og trengte 1 måneds rehabiliteringsopphold etter utskrivelse fra sykehus. Før det aktuelle hadde han vært svært sprek, og føler enda ikke han har kommet seg helt tilbake i den formen han var i. Han har i dag ingen plager fra mage og tarm. Siden da har pasienten gjennomgått prostataektomi grunnet sin prostatakreft, men har ellers ingen nye sykdommer.
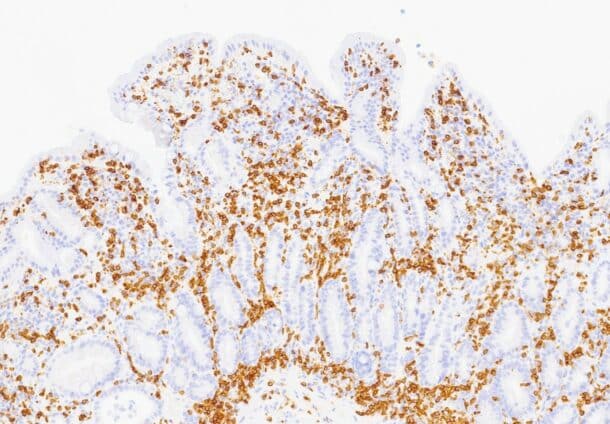
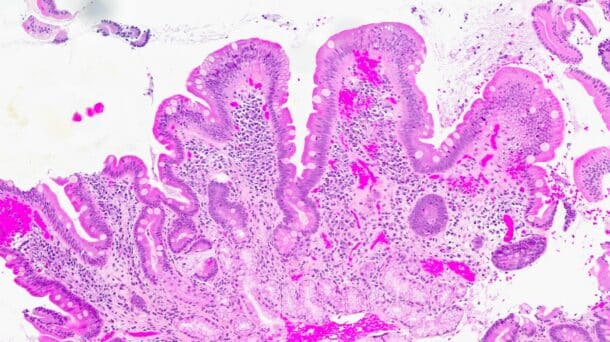
Enteropati med intestinal tottatrofi og negativ cøliakiserologi kan være en diagnostisk utfordring slik våre to kasuistikker illustrerer. I 2012 ble den første studien om ARB-indusert enteropati publisert (3). I januar 2024 ble det publisert en systematisk oversikt om samme tema, som så på 183 rapporterte kasuistikker (4). De vanligste symptomene er alvorlig diaré, vekttap og magesmerter. Pasientene kan ha tatt medikamentet i alt fra 1 måned til 14 år før symptomene inntrer. De typiske histologiske funnene på duodenalbiopsi er totteatrofi og økt antall intraepiteliale lymfocytter. Den samme litteraturen viser en viss økt forekomst av HLA-typene HLA-DQ2 og HLA-DQ8 hos denne pasientgruppen sammenlignet med den generelle befolkningen, men ikke på langt nær så definitivt som ved cøliaki. Svært få pasienter med olmesartanindusert enteropati hadde utslag på cøliakiassosierte antistoffer (4). Altså likner sykdommen på cøliaki histologisk og viser en mulig lik HLA-sammenheng, men fraværet av antistoffer og manglende respons på glutenfri diett gjør diagnosen cøliaki lite sannsynlig hos disse pasientene.
Man vet fremdeles svært lite om patogenesen bak ARB-indusert enteropati. En artikkel av Marietta fra 2015 fant at olmesartans påvirkning på tarmepitelet kunne minne om tarmepitelets respons på gluten hos cøliakere (6). Man fant blant annet økt antall CD8+ celler og økt utrykk av IL-15R hos epitelcellene i duodenalbiopsiene hos pasientene som brukte olmesartan.
Olmesartan er den ARB-en som hyppigst er assosiert med tilstanden. I den systematiske oversikten fra 2024 fant man at olmesartan var involvert i over 90% av kasuistikkene, men det har også blitt rapportert liknende kasuistikker med ARB-ene telmisartan, irbesartan, valsartan, lorsartan, kandesartan og eprosartan (4). Ifølge tall fra reseptregisteret var det 3061 registrerte brukere av virkestoffet olmesartanmedoksomil i Norge i 2020. Ved tilsvarende søk på alle ARB-er finner man totalt 525 800 brukere.
I begge kasuistikkene som ble presentert her var pasientene under utredning for sine plager i flere måneder, uten at medikamentbivirkninger ble grundig vurdert som en mulig årsak. En medvirkende forklaring på dette kan være at pasientene hadde brukt olmesartanmedoksomil i lang tid før symptomene slo inn, noe som ikke er det mest typiske ved legemiddelbivirkninger.
Likevel er det grunn til å tro at manglende kjennskap til ARB-indusert enteropati var den viktigste årsaken til den sene diagnostikken hos disse to pasientene.
Ved funn av et cøliakiliknende bilde histopatologisk, men negativ cøliakiserologi, burde man vurdere om en ARB kan være årsaken, og da særlig hvis pasienten behandles med olmesartan. Prognosen ser heldigvis ut til å være god, da de aller fleste pasienter kommer i full remisjon etter seponering av legemidlet.
Forfatterne oppgir ingen interessekonflikter med relevans for denne publikasjonen.