Jern har mange viktige funksjoner knyttet til energiomsetning, mens hemoglobinsyntese alltid har 1.prioritet. Jernmangel kan være forårsaket av økt tap, utilstrekkelig inntak eller absorpsjon fra tarmen og redusert frigjøring fra depoter ved systemisk inflammasjon. Anemi er en sen manifestasjon av jernmangel og vises først når lagrene er tomme. Behandling med peroralt jern er førstevalget når tarmen er frisk og pasienten er fri for betennelse, mens intravenøst jern gir rask, effektiv og sikker behandlingseffekt når peroral behandling ikke virker eller tolereres.
Bjørn Moum, Universitetet i Oslo og Sykehuset Østfold, Kalnes
Stefan Lindgren, Lunds universitet og Skånes universitetssjukhus, Sverige.
Jernmangel er et betydelig globalt helseproblem som påvirker millioner av mennesker over hele verden. Det er spesielt utbredt i lav- og mellominntektsland, men kan også påvirke befolkningen i høyinntektsland, inkludert Norge.
Hyppigste årsak til anemi globalt i 2021 var jernmangelanemi med prevalens på 422 leveår pr 100.000 personer (1). Mangel på jern kan ha alvorlige konsekvenser for helsen, fordi jern er en essensiell komponent i hemoglobin. Når kroppen ikke får tilstrekkelig jern, svekkes hemoglobinsyntesen, og anemi kan føre til tretthet, svakhet og redusert evne til å utføre daglige oppgaver. Jern har dessuten mange andre funksjoner i kroppen, og jernmangelen får også konsekvenser, i tillegg til dem som er direkte relatert til anemi.
En av de store utfordringene knyttet til jernmangel er tilgangen til næringsrik mat, spesielt for sårbare grupper som gravide kvinner, barn og personer i lavinntektsområder. Økonomiske begrensninger, utilstrekkelig tilgang til variert mat, avtagende kjøttkonsum og kulturelle faktorer kan alle bidra til utbredelsen av jernmangel (2,3).
Forebygging og behandling av jernmangel er viktig for å bedre global helse. Det kan inkludere tiltak mot utsatte grupper som de eldre, kostholdstilpasninger, beriking av matvarer med jern, og i noen tilfeller jernsubstitusjon. Imidlertid er det viktig å adressere underliggende årsaker til jernmangel, som tilgang til helsetjenester, kunnskap om ernæring og økonomiske forhold (4,5).
I Norge, som har gode helsetjenester og et variert kosthold, finnes grupper av befolkningen som er utsatt for jernmangel. Det er derfor viktig å være bevisst på problemet, og diagnostisere og implementere tiltak for å forebygge og behandle.
Ved mange kroniske inflammatoriske sykdommer har jernmangelanemi betydning for pasientenes helse og sykdomsforløp. Intravenøs jernbehandling har ofte vist seg å ha positive effekter på livskvalitet så vel som sykdomsforløpet.
Jern er det viktigste sporstoffet i organismen (6). I sin uorganiske form kan jern bytte mellom Fe2+ og Fe3+, som gir jern unike egenskaper for viktige redoksreaksjoner som å binde oksygen i hemoglobin, aktivere metabolske enzymsystemer og drive energiproduksjon. Fritt Fe2+ kan indusere dannelsen av frie radikaler som fører til skade på lipidmembraner, proteiner og DNA. Derfor må fritt Fe2+ holdes lavt. Flere ulike former for jernbindende proteiner regulerer effektivt jernmetabolismen.
Normalt daglig behov for jern er 1–2 mg. Kroppens jern fordeles til 60 % bundet i hemoglobin, 25 % lagret i ferritin, mens 15 % er bundet i myoglobin, enzymer og transferrin (Figur 1A). Eliminasjonen av jern skjer fremfor alt gjennom nedbrytningen av tarmepitelcellene hvor jern er bundet til ferritin. Tapene øker med systemisk betennelse når en større mengde jern lagres i enterocyttene. Jern gjenbrukes etter ødeleggelse av erytrocytter i kroppens makrofager, og jern transporteres bundet til transferrin for funksjoner i ulike organsystemer. Absorpsjonen av jern styres av proteinet hepcidin, som regulerer erytropoiesens tilgang til jern.
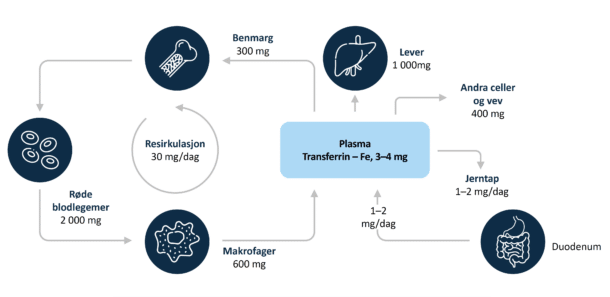
Anemi ved kronisk sykdom, også kalt sekundær anemi, er et resultat av immunaktivering. Immunaktiveringen kan forårsakes av infeksjoner, kroniske betennelsessykdommer, malignitet som ikke medfører benmargsinfiltrasjon og kronisk nyresvikt, særlig ved dialyse. Sikre tall for prevalens finnes imidlertid ikke. Angivelse av prevalens varierer betydelig, fra 8 % til 95 % i ulike studier (7,8).
Forekomsten av anemi øker med økende alder. Hos eldre er dette den vanligste anemiformen. I en amerikansk studie ble det funnet at rundt 10 % av personer over 65 år hadde anemi. Av disse hadde 17 % jernmangelanemi og 20 % anemi ved kronisk sykdom. Bare 6 % hadde anemi forårsaket av vitamin B12– mangel alene mens hos 34 % ble det ikke funnet noen forklaring på anemien (9).
Anemien kommer som regel snikende over en lengre tidsperiode, og kan være det første tegnet på en underliggende sykdom. Men som oftest preges sykehistorien av den tilgrunnleggende sykdommen, og anemien blir dermed ofte et bifunn. Vanlige årsaker er kronisk inflammasjon eller infeksjon, kreft, nyresykdom og leversykdom. Mekanismene bak anemien ved kronisk sykdom er mange og oftest parallelle. De vanligste årsakene er dårlig ernæring samt dårlig opptak av jern, vitamin B12 og folsyre. Anemi ses også ved nyresvikt på grunn av redusert erytropoietese og ved hjertesvikt pga redusert inntak av jern, nedsatt absorpsjon på grunn av lavgradig betennelse og ødematøs tarm og økt tap (platehemmere og antikoagulantia).
Akutt behandling, f.eks. blodtransfusjon, kan i noen tilfeller være aktuelt for å heve hemoglobinnivået ved faretruende lav verdi. I de tilfeller der anemien skyldes dårlig ernæring, er det viktig at den syke får i seg næringsriktig mat med tilstrekkelige mengder av jern og vitaminer. Jernbehandling skal kun gis når jernmangel er påvist, fordi jerntilskudd ellers kan forverre betennelsestilstander. Ved enkelte sykdommer kan det være nødvendig med supplerende behandling i form av jern, erytropoietin, vitamintilskudd og eventuelt transfusjon. Anemien vil som oftest bedres raskt når grunnsykdommen bedres.
Jernmangelanemi ved kronisk sykdom er en tilstand der kroppen ikke har tilstrekkelig mengde jern eller dette ikke er tilgjengelig for erytropoitesen for å produsere hemoglobin (10). Kroniske sykdommer kan derved påvirke jernmetabolismen og føre til funksjonell jernmangel.
Ved kronisk sykdom kan inflammasjon føre til økt produksjon av peptidet hepcidin i leveren. Dette har blant annet vært knyttet til produksjonen av proinflammatoriske cytokiner, spesielt IL-6. Økt hepcidinnivå hemmer både opptak av jern i tarmen og frigjøring av jern fra makrofager. Begge deler skjer ved at jerneksportproteinet ferroportin i enterocytt- og makrofagmembranen, under påvirkning av hepcidin, brytes ned. Det kan resultere i redusert tilgjengelighet av jern selv om det er tilstrekkelig jern i kostholdet og lagerjern. Hovedårsaken til utviklingen av anemi i forløpet av kroniske tilstander (f.eks. kronisk nyresykdom, revmatoid artritt) er derfor overdreven inflammatorisk aktivering (11,12).
Blødning fra tarmen kan være et resultat av skade på tarmslimhinnen ved kroniske sykdommer, og kan også bidra til jernmangel.
Jernmangel er spesielt hyppig hos overvektige pasienter på grunn av økte sirkulerende nivåer av akuttfase-reaktanter ved adipositas-assosiert inflammasjon. Det induserer redusert jernabsorpsjon korrelert med hemming av duodenalt ferroportinekspresjon parallelt med økte konsentrasjoner av hepcidin. Betennelse hos overvektige personer er derfor nært knyttet til jernmangelanemi. Overvektige personer får ofte redusert inflammatorisk respons etter fedmekirurgi ledsaget av redusert nivå av hepcidin og derfor forbedret jernabsorpsjon. Imidlertid kan gastrisk bypass-operasjon og sleeve-gastrektomi indusere malabsorpsjon i tynntarm og fremkalle jernmangel (13).
Behandlingen av jernmangelanemi ved kronisk sykdom fokuserer ofte på å håndtere den underliggende årsaken til jernmangelen, dvs. behandle den kroniske sykdommen. Jerntilskudd er ofte nødvendig for å kompensere for jernmangel. Imidlertid er det viktig å tilpasse behandlingen til den underliggende sykdommen. Siden inflammasjon via hepcidin blokkerer jernabsorbsjonen fra tarmen og frigjøring fra jernlagrene, kan intravenøs behandling derfor være førstevalget.
Det er viktig å rådføre seg med helsepersonell, som gastroenterolog eller hematolog, for en nøyaktig diagnose og behandlingsplan basert på individuelle behov og symptomer.
Både sammenhengen med så vel som betydningen av jernmangel ved kronisk fatigue er omdiskutert, men de negative konsekvensene av anemi er udiskutable, inkludert kronisk tretthet, kognitiv svikt, nedsatt fysisk funksjon, svekket utvikling og dårlig helserelatert livskvalitet (14).
Jernmangel uten anemi er svært vanlig i land med gode helsetjenester med en prevalens som varierer fra 16 % til 23 % hos premenopausale kvinner. I andre områder, som i Midtøsten, er det så mange som 58% av kvinnene i alderen 18–50 år med isolert jernmangel (15).
Jernmangel uten anemi er vist å kunne resultere i fatigue, kognitiv svikt og dårlig fysisk utholdenhet, og behandling bedrer tilstanden (16,17,18). At det er en glidende overgang fra jernmangel til jernmangelanemi gir utfordringer, da disse symptomene er uspesifikke og sammenhengen med isolert jernmangel derfor kan være vanskelig å fastslå. Derfor er også kriterier for hva som bør behandles langt fra avklart.
Det er som nevnt viktig å fastslå årsaken til jernmangelen før behandling påbegynnes, fordi underliggende årsaker bør kartlegges og behandles for å forhindre tilbakefall. Samtidig bør behandlingen tilpasses individuelle behov og toleranse for å unngå bivirkninger.
Personer med jernmangel uten anemi som bør behandles inkluderer de som har lavt ferritin eller lav transferrinmetning (TSAT, markør for jerntilgjengelighet). Dette kan omfatte personer med symptomer på jernmangel, selv om de ikke oppfyller kriteriene for anemi.
Gravide kvinner er en spesiell gruppe som ofte behandles for jernmangel selv før utvikling av anemi, da det er viktig for fosterets utvikling. Totalt er behovet minst doblet i forhold til perioden før svangerskapet. Personer med kroniske sykdommer som cøliaki, inflammatoriske tarmsykdommer eller nyresykdom kan også ha nytte av jernbehandling, selv om de ikke har utviklet anemi. Dette kan innebære bruk av jerntilskudd eller endringer i kostholdet for å inkludere mer jernrik mat. Det er sjelden behov for intravenøs behandling (19).
Diagnostisering av jernmangel og jernmangelanemi er utfordrende, og biokjemiske tester kan ikke entydig skille disse fra anemi ved kronisk sykdom (Figur 1B). Under normale omstendigheter er ferritin-nivået en sensitiv markør for jernstatus, men da ferritin er en akuttfasereaktant som stiger ved inflammasjon, kompliseres diagnostikken.
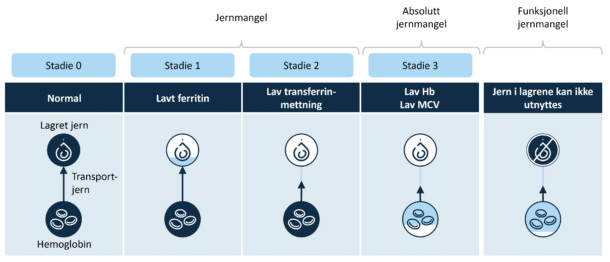
Proinflammatoriske cytokiner utløser også en økning i hepcidin, som begrenser opptaket av jern i kosten. Pasienter med aktiv kronisk inflammasjonssykdom kan dermed ha begrenset tilgjengelighet av jern til tross for normale eller høye nivåer av ferritin. Standardterskelen for jernmangel (ferritin <30 μg/l) (Tabell 1) gjelder derfor ikke, og TSAT bør inkluderes. Ferritin <100 μg/l eller TSAT <20 % kan betraktes som diagnostisk for jernmangel ved systemisk inflammasjon. Hvis ferritin er 100-300 μg/l, kreves TSAT <20 % for å bekrefte jernmangel. Rutinemessig overvåking av ferritin og TSAT i risikogruppene anbefales derfor. P-jern alene har svært liten verdi i diagnostikken. Løselig transferrinreseptor (sTfR) påvirkes ikke av kronisk eller akutt inflammasjon og har derfor høy sensitivitet og spesifisitet ved diagnostikk av jernmangelanemi. Det er viktig å huske på at jernmangel ikke kan utelukkes selv ved normalt hemoglobinnivå (Hb), fordi anemi er en senkomplikasjon til jernmangel (20).

Oralt jerntilskudd er trygt, rimelig og enkelt å administrere til friske personer og de gastrointestinale bivirkninger er typiske og velkjente. Utfordringene er imidlertid mange bivirkninger, og behandlingen må fortsette i opptil seks måneder for å normalisere Hb og fylle opp jernlagrene. Oralt tilført jern kan øke tarmbetennelsen ved kronisk inflammatorisk tarmsykdom og bidra til sykdomsforverring. Dessuten vil systemisk inflammasjon (som ved aktiv sykdom, da med CRP økning) gi økt hepcidin blokkering for peroral jernabsorbsjon.
Ferrimaltol (Ferracru®), et nytt ikke-salt oral jernformulering, er sammensatt av stabilt jern (III) kompleksbundet med et sukkerderivat, tri-maltol. Pga. jernets sukkerbinding reduseres dannelsen av fritt jern og dermed øker biotilgjengeligheten. Videre skal ferrimaltol ha mindre effekt på tarm mikrobiomet. Ifølge Felleskatalogen bør preparatet ikke anbefales ved kronisk inflammatorisk tarmsykdom med oppbluss eller ved hemoglobin <9,5 g/dl hos denne pasientgruppen.
Intravenøst jern er en rask og sikker måte å normalisere Hb og fylle opp jernlagrene på. Det virker også uavhengig av samtidig systemisk inflammasjon. Preparatene som brukes i Norge, jernkarboksymaltose og jernderisomaltose, er begge like effektive i så henseende. Jernsukrose og lavmolekylært jerndextran brukes, men i svært liten grad. Totalt behov for jern beregnes ut fra ferritin, Hb og pasientens vekt. Det er ikke noen grunn til å gi doser mindre enn 1 gram til voksne. Risikoen for overbehandling er svært liten, mens underhandling er vanlig. Seks til åtte uker etter at totaldosen er gitt, må effekten vurderes ved måling av ferritin og Hb. Deretter bør pasientens Hb og jernlagre overvåkes jevnlig i forhold til den bakenforliggende sykdom og ny behandling bør gis før jernmangelen eller anemien oppstår igjen. Alle preparatene er trygge, og hyppigheten av alvorlige allergiske bivirkninger er svært lav (1/250 000 gitte doser) (21).
Imidlertid opplever omtrent 1 % av pasientene en eller annen type bivirkning etter hver dose. Det absolutte flertallet av disse er av ikke-allergisk type, oppstår umiddelbart etter start av infusjonen og er raskt forbigående når behandlingen stoppes. Deretter kan infusjonen gjenopptas med en lavere infusjonshastighet (22). Det er viktig at både pasienter og behandlerne er godt informert om de vanlige bivirkningene og deres ufarlige natur. Jernløsningene skal ikke fortynnes i mer saltvann enn angitt, fordi fritt jern som årsaken til bivirkningene da øker. Jernkarboksymaltose kan forårsake hypofosfatemi, som bør bemerkes spesielt etter gjentatte doser (23).
Jern har mange viktige funksjoner knyttet til energiomsetning, og jernmangel har derfor flere konsekvenser for helserelatert livskvalitet. Imidlertid er hemoglobinsyntese alltid prioritert.
Jernmangel kan være forårsaket av økt tap, utilstrekkelig inntak, utilstrekkelig absorpsjon fra tarmen eller hepcidin-blokkering av absorpsjon og frigjøring fra depoter ved systemisk inflammasjon.
Anemi er en sen manifestasjon av jernmangel og vises først når lagrene er tomme. Diagnosen er basert på Hb, ferritin og TSAT. Om nødvendig kan sTfR lette diagnostikken, spesielt ved inflammasjonsrelatert jernmangel når ferritin-nivået er vanskelig å vurdere.
Behandling med oralt jern er førstevalget når tarmen er frisk og pasienten er fri for betennelse. Utfordringen er imidlertid mange bivirkninger, og behandlingen må fortsette i opptil seks måneder for å normalisere Hb og fylle opp jernlagrene. Når oral jernbehandling ikke virker eller tolereres, gir intravenøst jern en rask, effektiv og sikker behandlingseffekt.
Ved parenteral administrasjon må resultatet av behandling kontrolleres etter at beregnet dose er gitt og deretter fortløpende, for å hindre tilbakefall av jernmangel.