Av Kjetil Sunde, overlege, professor, avdeling for anestesiologi, Akuttklinikken, Oslo universitetssykehus og Universitetet i Oslo.
Hjertestans rammer ca. 40-60 mennesker per 100000 per år. Av disse skjer ca 70 % utenfor sykehus og av disse igjen ca 70 % i hjemmene. Total sett er ca 70 % av dem som får hjertestans, menn, og ca 70-80 % har kardial årsak. Gjennomsnittsalderen i de fleste studiene er rundt 60-65 år (1-3). Overlevelsen er p.g.a. den svært alvorlige tilstanden generelt dårlig, men gjennom bedre behandling i alle ledd i den såkalte redningskjeden (chain of survival, kjeden som redder liv) (figur 1) (4), har den i en rekke steder i verden blitt betydelig bedre de siste 10-15 årene (5-10).
Kjeden som redder liv, består av tidlig identifisering og varsling, tidlig basal hjerte-lunge-redning (HLR), tidlig defibrillering og tidlig og god behandling på sykehus etter gjenopprettet spontansirkulasjon (4). I Oslo ble overlevelsen mer enn doblet etter målrettet og systematisk bedring av de to svakeste leddene i behandlingskjeden (7).
Mens forskningen tidligere fokuserte på HLR og det å få pulsen tilbake, har forskningen de siste 10-15 årene dreiet veldig over på sykehusbehandlingen. Sentre som har målrettet og god sykehusbehandling, redder i dag opp mot 50-60 % av alle pasienter som legges inn etter primær vellykket resuscitering (11,12). Terapeutisk hypotermi, d.v.s. ett døgns nedkjøling av komatøse hjertestanspasienter, inngår i denne sykehusbehandlingen, og i lys av aktuell forskning skal dette diskuteres nærmere i denne artikkelen.
Når hjertet stopper å slå, opphører all vital sirkulasjon. Hjernen er det mest utsatte organet for denne iskemien, og mer enn 5 minutter med cerebral anoksi (ved normal temperatur) fører raskt til irreversibel nevrologisk skade. Det oppstår såkalte reperfusjonsskader, og tilstanden etter hjertestans er beskrevet som ”the post cardiac arrest syndrome” (13). Mekanismene for hjerneskaden er komplekse og multifaktorielle og er relatert til høye konsentrasjoner av toksiske metabolitter p.g.a. den globale iskemien og anaerobe metabolismen. Både under HLR og spesielt etter at hjertet slår igjen, sirkuleres disse slaggstoffene i kroppen og forårsaker sekundære iskemiske skader. Jo større omfang av iskemi, jo flere slaggstoffer, jo mer omfattende reperfusjonsskader og dårligere prognose. Spesielt dannelse av frie oksygenradikaler, eksitatoriske aminosyrer, laktatproduksjon, forstyrrelser i kalsium-balansen og Na-K-pumpen, apoptose-utvikling samt koagulasjonsforstyrrelser og dermed redusert mikrosirkulasjon, skader nevronene og er assosiert med økt mortalitet (13).
Terapeutisk hypotermi hos komatøse hjertestanspasienter ble første gang anbefalt av International Liassion Committee on Resuscitation (ILCOR) i 2003 (14). Terapeutisk hypotermi har vært definert som 12-24 timers (24 timer har vært vanlig) nedkjøling av kroppstemperaturen til 32–34 °C, før langsom oppvarming til normotermi. Anbefalingen kom etter at to randomiserte, kontrollerte studier fra Europa og Australia i 2002 viste at terapeutisk hypotermi bedret overlevelse og nevrologisk funksjon seks måneder etter hjertestans (15,16).
Gjennomføringen av de to randomiserte studiene (15,16) var basert på langvarig forskning. En rekke dyre-eksperimentelle studier hadde vist den beskyttende effekt av nedkjøling på reperfusjonsskadene som oppstår etter global iskemi ved hjertestans (13). Det er hjernen som er særlig utsatt for denne type skade, og irreversible hjerneskader er også hovedårsaken til at pasienter dør etter hjertestans (17-19). I tillegg reduseres metabolismen med 6 -10 % per °C (20), og kroppens totalbehov for oksygen reduseres betydelig (21). Dette er gunstig i en kritisk fase hvor oksygenmangel til vitalt vev truer sirkulasjonen. Tidligere studier hadde vist at tidlig hypertermi (d.v.s. temperatur over ca 37,5 °C) etter hjertestansen var assosiert med økt mortalitet (22, 23). Tre ikke-randomiserte studier (24-26) hadde gitt en indikasjon på at funnene fra de dyre-eksperimentelle studiene virket relevante, med bedret overlevelse med god nevrologisk funksjon etter nedkjølingsbehandling sammenlignet med historiske kontroller med tradisjonell behandling. Så, med publikasjonene i 2002 hadde man for første gang kunnet dokumentere en effektiv post-resusciterings-behandling, med ”Numbers Needed to Treat” (NNT) på 6, d.v.s. man måtte behandle seks pasienter for å få en gevinst med én vellykket overlever (1, 2).
I Norge ble terapeutisk hypotermi raskt anbefalt (27), og flere publikasjoner kom tidlig fra Norge vedrørende denne lovende behandlingsmetoden (11, 28, 29). Både American Heart Association (AHA) og European Resuscitation Council (ERC) forsterket også den terapeutisk hypotermi-anbefalingen i sine retningslinjer fra 2010 (1, 2, 30) basert på ytterligere positive data. Internasjonale publikasjoner fra store registre viste betydelig bedret overlevelse spesielt m.t.p. nevrologisk funksjon, og ingen negative studier har blitt publisert (31-37). Spesielt viktig er det at ingen alvorlige bivirkninger har vært rapportert i forbindelse med terapeutisk hypotermi, og behandlingen har derfor vært ansett som trygg og effektiv (1, 2, 11, 15, 16, 30-39). ILCOR bemerket dog i 2010 at det fortsatt var en rekke ubesvarte spørsmål i forhold til terapeutisk hypotermi:
for å nevne noen (1).
Det er viktig å presisere at terapeutisk hypotermi er en del av en standardisert målrettet behandlingsprotokoll som må iverksettes så raskt som mulig etter at pasienten ankommer sykehus. I akuttfasen og under intensivoppholdet er det viktig å tidlig optimalisere de vitale funksjoner hos disse kritisk syke pasientene. Det er viktig å finne årsaken til hjertestansen og behandle denne. Akutt koronar-sykdom og/eller kronisk iskemi er de vanligste direkte årsakene til hjertestans, og dette må tidlig detekteres og behandles etter dagens retningslinjer. Med en standardisert behandlingsprotokoll sørger man for å optimalisere hemodynamikk med positiv væskebalanse første døgn, bruk av vasopressorer og/eller inotropi samt evt. aortaballong-pumpe hos dem med uttalt pumpesvikt, i tillegg til normooksygenering, normoventilering og kontroll av metabolisme, blodsukker og eventuelle komplikasjoner som måtte oppstå (1, 2, 11, 30). Med en slik tilnærming til post-resusciteringsbehandlingen på sykehuset, med terapeutisk hypotermi som en del av denne behandlingen, ble overlevelsen mer enn doblet (fra 26 % til 56 % med god nevrologisk funksjon) blant innlagte hjertestanspasienter i en norsk studie (11), og den samme gode overlevelsen har vedvart siden (12).
Det er flere måter å kjøle ned pasienten på. Den enkleste og billigste metoden er å kombinere kalde infusjoner (30-40 ml/kg med 0,9 % NaCl eller Ringer-acetat) med ispakker (f.eks. sportsis) i lyske, armhule og på hals/nakke (11, 12, 14, 28, 32-34, 40-42). Ekstern kjøling kan også gjøres med diverse utstyr av forskjellige kjøleelementer som plasseres på kroppen, og som i dag stort sett har gjennomstrømning av vann med regulert temperatur (ekstern kjøling). Man kan også bruke mer invasive metoder med endovaskulær kjøling, hvor væskefylte spesialkatetre legges inn i store vener (med standard seldinger-teknikk), koplet til maskiner som kan regulerer temperaturen (intern varmeutveksling). Det finnes også andre mer eller mindre invasive metoder, og stadig flere metoder kommer på markedet. Det er i dag ingen spesiell metode som anbefales for å oppnå terapeutisk hypotermi (1, 2, 30). Avdelingen bør bruke den metoden den har erfaring med og som er tilpasset intern logistikk og finansielle situasjon. En norsk studie sammenlignet endovaskulær kjøling med ekstern kjøling, men fant ingen store forskjeller i temperaturrelaterte data, bivirkninger eller overlevelse (43).
Selv om det anbefales hurtig nedkjøling, vet vi imidlertid ikke sikkert den kliniske gevinsten ved hurtig kjøling, hva som er optimal temperatur og hva som er optimal varighet av kjøling og oppvarming (1, 2, 30). Noen dyreforsøk har vist at hypotermi rett etter gjenopprettet spontant sirkulasjon (ROSC) er assosiert med bedret overlevelse (44, 45), mens andre har viste at det synes å være et terapeutisk vindu (46, 47). Gevinsten av tidlig nedkjøling er ikke bekreftet i store kliniske studier (1, 2, 34), men dette påvirkes også av at de som er kaldest ved innkomst, og lettest å kjøle raskt, er de med dårligst prognose (48, 49). En nylig randomisert studie fra USA viste at prehospital infusjon av stort volum kalde væsker etter primært vellykket resuscitering riktignok førte til at pasientene var kaldere ved innleggelse, men det var ingen forskjell i overlevelse. Imidlertid var det flere episoder av gjenoppstått hjertestans i intervensjonsgruppen, slik at ukontrollert infusjon av store volum kalde væsker prehospitalt ikke er å anbefale (50).
De seneste årene har det pågått en diskusjon om evidensgrunnlaget for terapeutisk hypotermi og eventuelt behov for en ny studie (51, 52). Niklas Nielsen og medarbeidere gjennomførte derfor en multisenterstudie (Target Temperature Management (TTM) i 12 land (53). Norge har vært representert med Oslo universitetssykehus, Rikshospitalet, og Haukeland universitetssjukehus. I den meget vel planlagte og gjennomførte TTM-studien, ble pasientene randomisert til aktivt temperaturkontroll til enten 33 eller 36 °C i 24 timer. Utover terapeutisk hypotermi til to forskjellige nivåer, var behandlingen ellers lik mellom gruppene. Det forelå også standardiserte predefinerte mål for prognostisering og eventuell terminering av behandling. Med sine 950 inkluderte pasienter er dermed dette den største randomiserte studien gjennomført med terapeutisk hypotermi ved hjertestans. Studien fant en svært god overlevelse (rundt 50 %) i begge gruppene, altså ingen forskjell om man ble kjølt til 33 eller 36 °C. I de pre-definerte sub-gruppeanalysene fant man heller ingen signifikante forskjeller. Det var heller ingen signifikante forskjeller i alvorlige bivirkninger mellom de to gruppene (53).
TTM-studien sammenlignet to forskjellige nivåer av terapeutisk hypotermi, eller målrettet temperaturkontroll, som vi også kan kalle det. Således er det ikke en naturlig konklusjon av TTM-studien å stoppe med all form for nedkjøling. Uten temperaturkontroll vil temperaturen stige, og dette vet vi øker sjansen for død og hjerneskade (1, 13, 22, 23) (figur 2). Senere studier har også vist at hypertermi etter nedkjølingsperioden er assosiert med økt mortalitet (54, 55). Temperaturkontroll er derfor fortsatt nødvendig etter hjertestans, og dette krever aktive tiltak for å holde temperaturen nede med en sedert pasient koplet til respirator. Men dybdenivået av nedkjølingen, er på bakgrunn av TTM-studien, under internasjonal og nasjonal debatt. ILCOR har nylig anbefalt at man fortsatt bør gjøre det man er vant til å gjøre, d.v.s. har man de siste årene kjølt til 33 °C, så bør man fortsette med det inntil mer data foreligger; spesielt langtids kognitiv funksjon i de to gruppene. ILCOR presiserte imidlertid, basert på resultatene fra TTM-studien, at man nå synes å ha et større temperatur-vindu enn det til nå anbefalte 32-34 °C-nivået. Sentre som vil kjøle til 36 °C kan derfor gjøre det, dersom de mener det gagner deres pasienter bedre (56).
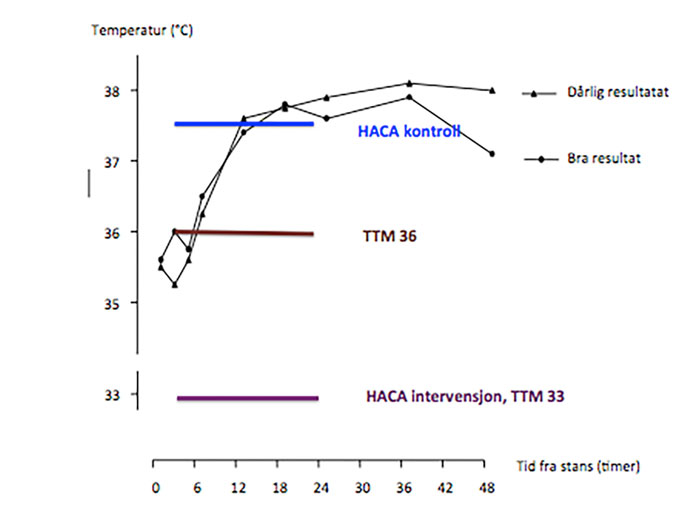
Figur 2 : Temperaturutvikling etter hjertestans dersom man ikke manipulerer med temperaturen (svarte linjer, fra Zeiner et al, referanse 22). Bemerk den initiale lave temperaturen som raskt stiger de neste 48 timene og er signifikant forskjellig mellom de som har godt eller dårlig resultat.
De forskjellige fargede strekene indikerer de forskjellige temperatur-nivåene brukt i de to mest sentrale randomiserte studiene: HACA – den europeiske multisenterstudien fra N Engl J Med 2002 (referanse 15) og TTM – 33 vs 36 ºC multisenterstudien fra N Engl J Med 2013 (referanse 53).
Viktig å bemerke at det er betydelig bedret overlevelse med god nevrologisk funksjon i TTM 33 og 36 ºC samt HACA 33 ºC versus HACA kontroll og ingen temperaturmanipulasjon. Man vil ha overlevere også uten temperaturmanipulasjon, men antallet med god nevrologisk funksjon vil være lavere. Hypertermien er skadelig (modifisert etter Zeiner et al, Arch Internal Med 2001).
Jeg støtter ILCORs anbefaling og mener at man basert på en nøytral studie uten forskjeller i alvorlige bivirkninger skal være forsiktig med å endre en praksis som har vist seg svært vellykket over mange år, og som har solid dyreeksperimentell og klinisk dokumentasjon (1, 2, 13, 30). Riktignok er TTM-studien den til nå største innen terapeutisk hypotermi, og uten tvil den best gjennomførte, men det er en rekke spørsmål som kan diskuteres og bør grundigere evalueres før man anbefaler en endring av dagens kliniske praksis. De to viktigste aspektene kan oppsummeres slik:
Kognitiv funksjon hos overlevere: Vellykket overlevelse var i TTM-studien definert som det anbefalt brukte Cerebral Performance Categori (CPC) 1 og 2, hvor 1 er normal og 2 er tilnærmet normal (1). Men det er stor forskjell for både pasient og pårørende om man er en god CPC 1 eller en dårlig CPC 2. I denne studien var 42 % av pasientene i 33 ºC-gruppen CPC 1 vs. 39 % i 36 ºC-gruppen (ikke signifikant), mens 5 % og 8 % var i CPC 2 i henholdsvis 33 ºC- og 36 ºC-gruppen (igjen ikke signifikant). CPC-scoringen er relativ overfladisk og sier ingen ting om kognitiv funksjon eller psykososialt funksjonsnivå. Terapeutisk hypotermi påvirker en rekke nevrologiske prosesser, og i henhold til dyre-eksperimentelle data kan nivået av terapeutisk hypotermi ha en påvirkning på dette (1, 13, 44-47). Mange pasienter har kognitive funksjonsforstyrrelser etter hjertestans (57), men vi vet av erfaring de siste 10-15 årene at funksjonen til mange bedrer seg over tid. I TTM-studien var det signifikant flere pasienter som gikk fra CPC 2 til CPC 1 i 33 ºC- gruppen vs. 36 ºC-gruppen fra utskrivelse av sykehus til et-halvtårs kontrollen (62 vs 40 pasienter, p= 0,01) (58). Etter min mening bør vi vite mer om langtids (d.v.s. 1-2 år) livskvalitet og kognitiv funksjon før man eventuelt skulle bytte terapeutisk hypotermi-dybde.
Prognostisering: TTM-studien hadde en grundig og velfundert prognostiseringsplan som alle deltagende sentre måtte forholde seg til. Dette er viktig fordi prognostisering påvirker overlevelsestallene. Avslutning av aktiv behandling av fortsatt komatøse pasienter, på bakgrunn av en estimert eller dokumentert alvorlig hjerneskade, er den vanligste dødsårsaken under intensivoppholdet; ca. 50 % av pasientbehandlingen ble avsluttet basert på prognostisering i to uavhengige studier (12,19). Det valgte tidspunktet (ca. 5 dager) i TTM-studien følger dagens anbefalinger (59,60), men man kan likevel diskutere tidspunkt for prognostisering i TTM-studien siden det ble gjort til samme tidspunkt i begge grupper (53). Jo dypere nedkjøling, jo mer redusert metabolisme og forlenget effekt av sedativa og dermed lenger tid til oppvåkning, spesielt for 33 ºC-gruppen (1, 13). Dette kommer da også frem i TTM-studien: På tidspunkt for prognostisering (etter 117 timer i 33 ºC-gruppen vs. 119 timer i 36 ºC-gruppen) var signifikant flere pasienter våkne i 36 ºC-gruppen vs. 33 ºC-gruppen (52 % vs. 44 %, p=0,03) (58). Egen erfaring tilsier at mange komatøse pasienter som er kjølt til 33 °C i 24 timer og som er dypt sedert, bruker mange dager før de våkner til en adekvat funksjon. I en fersk studie fra Minnesota var det blant 89 overlevere etter terapeutisk hypotermi til 33 °C 10 pasienter som våknet til vellykket nevrologisk funksjon betydelig senere enn døgn 5 etter hjertestansen (61). Med 472 pasienter inkludert i 33 ºC-gruppen kan for tidlig prognostisering og avslutning av behandling ført til at man har mistet potensielle vellykkete overlevere. Både den pågående NORCAST-studien på Oslo universitetssykehus, Ullevål (Clinical Trials Gov ID 01239420 – inkludert 250 pasienter) og planlagte sub-studier fra TTM vil belyse viktige aspekter spesielt rundt tidspunkt for prognostisering, slik at mer data etterhvert vil foreligge.
Hjertestanspasienter er kritisk syke intensivpasienter, de er sepsis-like (62), og en rekke komplikasjoner kan oppstå som følge av reperfusjonsskadene forårsaket av den globale kritisk iskemiske perioden (13). Det er viktig å presisere at det ikke har vært påvist flere bivirkninger eller noen skadelige effekter av terapeutisk hypotermi i kliniske studier (1, 2, 11, 15, 16, 30-39) og ingen direkte effekter som er assosiert med økt mortalitet (39), selv om behandlingen selvfølgelig i denne fasen ofte kan være komplisert. Heller ikke i TTM-studien var det noen signifikante forskjeller i alvorlige bivirkninger (53, 57).
Skjelvinger forekommer hos rundt 20 % av hjertestanspasientene under terapeutisk hypotermi (13, 43). Interessant nok er skjelvinger faktisk assosiert med bedre overlevelse da dette viser respons og intakte forsvarsmekanismer hos pasienten (43, 63). Det ser imidlertid ubehagelig ut, kan føre til stress og økt oksygenforbruk og kan dermed bli et problem som greit kan unngås ved dypere sedering og eventuelt muskelrelaksantia. Bruken av rutinemessig kontinuerlig muskelrelaksantia diskuteres, men på Oslo universitetssykehus, Ullevål gjør vi det ikke. Det viktigste er å ha en klar sedasjonsplan; pasientene må være dypt sedert under terapeutisk hypotermi-perioden.
Under selve nedkjølingsfasen er hjertestanspasienten kanskje i sin mest ustabile fase. Hemodynamikken er påvirket, en post-resusciterings myokardial dysfunksjon foreligger (13, 64, 65), og pasienten trenger oftest både væske, vasoaktiv medikasjon og i noen tilfeller også mekanisk støtte for å opprettholde adekvate vital sirkulasjon (11-13, 65). Denne fasen krever derfor spesiell oppmerksomhet m.h.t. kontroll av hemodynamikk, ventilasjon, sedasjon, elektrolytter, væskebalanse, vasoaktiv medikasjon og insulin/blodsukkerkontroll (1, 2, 11, 30). P.g.a. lavere metabolisme ved redusert temperatur er det særlig viktig å hyppig kontrollere pCO2, da hyperventilasjon lett kan oppstå hvis man ikke reduserer tidalvolumene på respiratoren. Hyperventilasjon reduserer cerebral vital sirkulasjon og må unngås (1, 2, 13).
Ofte blir pasientene litt bradykarde (ofte ned mot 40/min og noen ganger enda lavere) når temperaturen er under 35 °C; det oppstår en beta-blokker-lignende effekt (66-68). I tillegg kan den diastoliske dysfunksjonen bli ytterligere redusert av terapeutisk hypotermi (68,69), selv om kontraktiliteten faktisk ser ut til å øke noe (66-68). Bradykardien beskytter mot denne diastoliske dysfunksjonen og ser dermed ut til å være gunstig for hemodynamikken under terapeutisk hypotermi. Øker man hjertefrekvensen, vil man forverre denne diastoliske dysfunksjonen (66-69). En studie på pasienter med kardiogent sjokk etter hjertestansen viste at terapeutisk hypotermi virket gunstig på hemodynamikken (70). En nylig akseptert studie fra Oslo universitetssykehus, Ullevål viser at bradykardi under terapeutisk hypotermi-perioden er assosiert med bedret overlevelse. Pasienter som er bradykarde, kan ansees som respondere til behandlingen, og bradykardien kan ansees som en markør for mulig godt utkomme, mens takykardi er et dårlig tegn (71). Det er også tidligere vist at takykardi er assosiert med økt mortalitet (72). Dette viser at hjernen klarer seg fint med noe lavere hjerteminuttvolum under terapeutisk hypotermi, men det er ikke gjort studier som har sammenlignet for eksempel hvilket blodtrykksnivå som er akseptabelt i denne fasen. De fleste sentre anbefaler i dag MAP på over 65 mm Hg, men ut fra patofysiologien og forståelse av terapeutisk hypotermi er kanskje dette for høyt. Basert på studien fra Stær-Jensen et al. kan vi i alle fall konkludere med at dersom blodtrykk, laktat, SvO2 er akseptabelt, lar man bradykardien være (71). Dersom man ønsker økt frekvens p.g.a. dårlig hemodynamikk, bør man heve temperaturen litt; det er mest effektivt. Men prospektive studier rundt hemodynamikk ved terapeutisk hypotermi er ytterst nødvendige.
Terapeutisk hypotermi eller målrettet temperaturkontroll er en viktig del av sykehusbehandlingen etter hjertestans. Selv om TTM-studien åpner for et større temperatur-vindu, fra 33 til 36 °C, er det basert på all evidens som foreligger per i dag (dyre-eksperimentelle og randomiserte studier samt observasjonsstudier og register-data) ikke noe som tilsier at man må endre temperaturnivå ennå. Derfor bør man følge ILCOR sin anbefaling om å fortsette med det man har gjort med suksess de siste 10-12 årene før nye internasjonale retningslinjer kommer i 2015. Kognitiv og daglig funksjon i årene etter hjertestansen vil være det sentrale spørsmål m.t.p. det temperaturnivået som er å foretrekke.
Artikkelen er tidligere publisert i Hjerteforum nr 3 2014 og trykkes med tillatelse.
Resten av refansene kan fås ved henvenvendelse til forfatter.