
Svend Aakhus
Av Svend Aakhus, seksjonsoverlege, Kardiologisk avdeling, OUS Rikshospitalet, Professor, Det medisinske fakultet, NTNU.
Cecilie Kiserud, Enhetsleder, PhD, Nasjonal kompetansetjeneste for seneffekter etter kreft, OUS, Radiumhospitalet
Medisinsk diagnostikk og behandling av kreftpasienter har blitt bedre og mer individualisert over de siste årtier, behandlingen er mindre belastende og flere overlever kreft og kreftbehandling i dag enn tidligere Likevel får mange pasienter komplikasjoner etter avsluttet behandling, såkalte seneffekter. Disse kan i prinsippet ramme alle organsystemer og også pasientens mentale tilstand. Vi skal her omtale seneffekter av kreftbehandling på hjertet.
Medisinsk diagnostikk og behandling av kreftpasienter har blitt bedre og mer individualisert over de siste årtier. Det er derfor mange flere som overlever kreft og kreftbehandling i dag enn tidligere, og prevalensen av kreftoverlevere øker (Figur 1). Noe av forklaringen er en mer effektiv og samtidig skånsom kreftbehandling. For eksempel er man meget nøye med å ikke overskride kumulativ maksimaldose av anthracyckliner, og med å optimalisere strålebehandling. Dagens kreftbehandling er mindre belastende enn for 20 år tilbake for noen pasientgrupper. Dette er den virkelig gode medisinske nyheten. Likevel får mange pasienter komplikasjoner etter avsluttet behandling, såkalte seneffekter. Disse kan i prinsippet ramme alle organsystemer og også pasientens mentale tilstand. Vi skal her omtale seneffekter av kreftbehandling på hjertet.
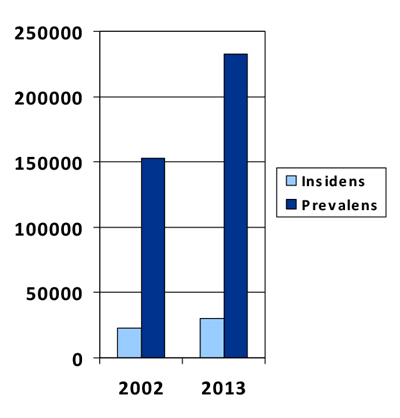
Figur 1: Prevalens og insidens av kreftsykdom i Norge 1998 og 2013. (Kilde: Kreftregisteret).
Strålebehandling mot mediastinum og hjerte er aktuelt ved behandling av lymfomer og brystkreft, og kan gi fibrose i perikard, klaffer og koronarkar (Figur 2). Mest utsatt er perikard og aortaklaffen. Det tar ofte lang tid fra skaden er etablert til klaffefeil av betydning oppstår. Wethal og medarbeidere (1) fant for eksempel at 39% av lymfompasienter utviklet aortastenose mellom første og andre dekade etter avsluttet mediastinal strålebehandling.
Anthracykliner er et cytostatikum som anvendes ved en rekke kreftsykdommer for eksempel brystkreft og lymfom. Anthracykliner påvirker cellenes arvestoff, og kan i høye doser gi en varig svekkelse av hjerte-muskulaturen. Hjerteforandringene kan komme akutt eller etter avsluttet behandling. Man er derfor blitt meget nøye med ikke å overskride anbefalte maksimale kumulative doser for anthracycliner, og vi ser færre anthracyclininduserte kardiomyopatier nå enn tidligere. Likevel antas 2-5% av pasientene å få en målbar svekkelse av venstre ventrikkel.
Norske forskningsgrupper har undersøkt kardiovaskulær funksjon etter kreftbehandling. Murbraech og medarbeidere (2) undersøkte voksne lymfompasienter behandlet med høydose cytostatika og autolog stamcellestøtte, gjennomsnittlig 13 år etter at diagnosen ble stillet. De fant at 16% hadde redusert venstre ventrikkelfunksjon (EF < 50%), og 11% hadde symptomer på hjertesvikt. I samme gruppe, hadde 22% klaffefeil bedømt med ekkokardiografi, og de som hadde fått mediastinal bestråling hadde høyest forekomst (3).
Trastuzumab (Herceptin) er et monoklonalt antistoff mot HER2 og brukes i behandling av enkelte typer mammacancer. Herceptin kan lede til hjertesvikt ved direkte hemning av kardiomyocyttenes funksjon. Ca 10% får en påvisbar, men asymptomatisk, svekkelse av venstre ventrikkel, mens 3% får en symptomatisk hjertesvikt. Effekten er heldigvis reversibel hos de fleste, og hjertet vil gjenvinne normal funksjon når trastuzumab seponeres.
Cisplatin brukes ved testikkel- og ovarialcancer. Cisplatin kan skade endotel og derved medføre seneffekter på arteriene. Pasienten har derfor øket risiko for å utvikle hypertensjon og arteriosklerose. Haugnes og medarbeidere fant at cisplatinbehandlede overlevere etter testikkelkreft hadde henholdsvis 2 og 4 gangers øket risiko for hypertensjon og diabetes, sammenlignet med befolkningen forøvrig (4). Pasienter som hadde fått både cisplatin og stråleterapi hadde høyest risiko. Spesielt må man være oppmerksom på utvikling av koronarsykdom hos disse pasientene.
Cisplatin kan også ha effekter på hjertemuskulatur. Murbraech og medarbeidere fant at både diastolisk venstre ventrikkelfunksjon og systolisk høyre ventrikkelfunksjon var redusert hos pasienter som var behandlet med høydose cisplatin mot ovarialcancer (5).
Kreftbehandling av barn og unge representerer en egen utfordring. Christiansen og medarbeidere fant i en undersøkelse av unge lymfomoverlevere at 50% hadde tegn på venstre ventrikkel dysfunksjon eller signifikant klaffefeil vel 20 år etter at diagnose var stilt, og at 55% av de som hadde fått mediastinal strålebehandling, hadde klaffefeil (6). Det er likevel viktig å merke seg at forskjellen mellom pasienter og kontrollgruppen ikke var store, Hos overlevere etter akutt leukemi, behandlet før voksen alder, fant samme forfatter noe redusert arbeidskapasitet bedømt ved ergospirometri, i alt overveiende hos de behandlet med antracyckliner (56% med subnormalt maksimalt O2 opptak). Disse pasientene hadde også noe redusert venstre ventrikkelfunksjon, men forskjellene var heller ikke her store (7). Samlet understreker disse arbeidene at kreftbehandling av både barn og voksne gir målbare negative effekter på hjertefunksjonen, men at forskjellen fra en normalbefolkning er liten, og at de fleste kommer godt ut etter behandlingen med et bra fysisk funksjonsnivå.
Risiko for utvikling av kardiovaskulær sykdom øker med kreftbehandlingens kompleksitet. Høyest forekomst av kardiovaskulære bivirkninger er vist hos kreftoverlevere som har vært behandlet med både anthracykliner og stråling (8). Det samme gjør seg gjeldende sent i forløpet etter kreftbehandlingen (2-3, 5-7).
Det er altså et økende antall pasienter som overlever sin kreftbehandling, men med en økt risiko for å utvikle hjerte- og karsykdom. Hvordan skal dette håndteres?
De fleste av pasientene har lite bivirkninger og kan følges av fastlege. Det viktigste er at legen kjenner til pasientens tidligere kreftbehandling, og er oppmerksom på mulige komplikasjoner til denne. Det vil være naturlig å henvise pasienter til sykehus dersom de utvikler symptomer, eller hvis en har andre holdepunkter for at seneffekter har tilkommet.
Tradisjonelt har venstre ventrikkel blitt vurdert ved scintigrafiske teknikker (MUGA). Ekkokardiografi er imidlertid mer tilgjengelig, rimeligere og uten bivirkninger (ingen ioniserende stråling), og er derfor blitt den anbefalte teknikk for oppfølging av hjertefunksjonen hos disse pasientene.
Det er viktig å redusere behandlingsintensitet der dette er mulig, eventuelt avbryte behandlingen om pasienten utvikler hjertesvikt. Denne beslutningen kan naturlig nok få store konsekvenser for pasienten og må vurderes nøye.
Etablerte kriterier for kardiotoksisk effekt foreligger likevel ikke. Mest brukt er kriteriet om reduksjon i EF på minst 15% om EF før behandling var normal (> 50%), eller minst 10% om EF var redusert (< 50%). Nyere og mer presise ekkokardiografiske teknikker forventes å supplere EF som mål på venstre ventrikkel funksjon. Det er fortsatt uavklart om man kan unngå hjertesvikt ved å behandle pasienter med hjertesviktmedikamenter under kardiotoksisk behandling. Preliminære data indikerer dette (9). Flere studier påghår nå for å gi svar på dette, deriblant multisenterstudien Succour (ANZ Clinical Trial Registry) hvor Oslo universitetssykehus deltar.
Vanlige retningslinjer for reduksjon av hjerte- og karrisiko gjelder også for denne populasjonen. Målet er normalt blodtrykk, blodsukker og blodlipider, evt. ved hjelp av medikamentell behandling. Pasienter som utvikler kliniske eller ekkokardiografiske symptomer på hjertesvikt bør snarlig utredes. ProBnP er en nyttig biokjemisk parameter. Konvensjonell hjertesviktbehandling med ACE hemmere og betablokker bør startes tidlig i forløpet. Ved uttalt hjertesvikt med redusert venstre ventrikkel og venstre grenblokk kan det også være indikasjon for resynkroniseringsterapi med biventrikulær pacemaker (se egen artikkel). Endel pasienter utvikler etter strålebehandling behandlingstrengende klaffesykdom, vanligst er aortastenose. Disse kan være tilgjengelige for konvensjonell kirurgi med innsettelse av kunstig hjerteventil. En skal være oppmerksom på at operasjonsrisiko er øket på grunn av stråleskader i perikard og hjertets bindevev. Enkelte pasienter utvikler en betydelig stråleskade i perikard, med kronisk perikarditt og konstriksjon som konsekvens. Av og til blir det aktuelt med kirurgisk behandling av tilstanden. For noen få pasienter vil hjertetransplantasjon være alternativet.
Det er viktig at pasienten og fastegen har kunnskap om pasientens medisinske historie og mulige seneffekter av behandling. Spesialisthelsetjenesten må samarbeide om å etablere et kompetent tilbud for oppfølging av de mer kompliserte onkologiske pasientene (10,11). Her må blant andre onkolog, kardiolog og thoraxkirurg delta i vurderingene. Legeforeningen har anbefalt at en slik kardio-onkologisk enhet etableres på Oslo universitetssykehus (12). En antar at ca 10% av kreftoverlevere vil ha behov for slik spesialisert teamoppfølging (13).
Referanser