
Andreas Lossius.
Av Andreas Lossius, Lege og postdoktor, Nevrologisk avdeling Ahus og OUS, og Immunologisk avdeling, OUS Rikshospitalet.
Multippel sklerose er en kronisk betennelsessykdom i sentralnervesystemet som rammer unge voksne. Den utløsende årsaken er ikke kjent, men flere genetiske og miljømessige risikofaktorer til sykdommen har blitt funnet. Behandling som retter seg mot den adaptive komponenten av immunsystemet ser ut til å være svært effektiv, og det siste tiåret har en rekke nye medikamenter blitt godkjent.
Arvbarheten ved multippel sklerose (MS) er anslått til å ligge et sted mellom 25% og 76% (1). Dette forteller oss at vi trenger studier av både gener og miljø for å forstå hvorfor noen utvikler sykdommen. Den sterkeste genetiske assosiasjonen til MS ble funnet allerede på begynnelsen av 70-tallet og er knyttet til bestemte HLA-molekyler (2). Senere ble det funnet at dette mest sannsynlig er knyttet til allelet for HLA DRB1*15:01, som øker sykdomsrisikoen to til tre ganger (3). Funksjonen til HLA-molekyler er å fasilitere presentasjon av antigener for T-celler, som er en type lymfo-cytter i det adaptive immunsystemet.
En HLA-assosiasjon indikerer derfor at den adaptive immunresponsen i alle fall hos en andel av MS-pasientene kan være rettet mot et ennå ukjent antigen – et autoantigen eller et infeksiøst agens. I nyere tid har det blitt gjort store genetiske studier, såkalte genomvide assosia-sjonsstudier, som har identifisert over 100 nye gener som kan være assosiert med MS (4). Blant disse genene er det en overhyppighet av gener som er viktige for immun-systemet, noe som ytterligere støtter hypotesen om at immunsystemet er involvert i årsaken til sykdommen.
Biologiske søsken til individer med MS har en sykdomsrisiko på tre til fire prosent, mens adopterte søsken har en risiko på rundt 0,1 prosent, som er den samme som resten av befolkningen (5). Dette viser at den økte sykdomsrisikoen hos biologiske søsken er genetisk betinget, og miljøfaktorene ved MS må derfor være utbredt i befolkningen og ikke begrenset til enkelte familier. Såkalte migrasjonsstudier, der man har studert sykdomsrisikoen hos individer som har flyttet fra områder med høy til lav forekomst, viser at risikoen for MS reduseres hvis man flytter i barneår eller tidlig ungdomsår (6). De miljøfaktorene som mest konsistent er vist å være assosiert med MS er infeksjon med Epstein-Barr virus (EBV), røyking og lave nivåer av vitamin D i blodet (7).
For EBV er det vist at så godt som alle pasienter med MS har hatt infeksjonen (8). Dette må imidlertid sees opp mot at 90 til 95% av alle friske voksne også er seropositive for viruset, noe som viser at smitte med EBV ikke er en tilstrekkelig årsaksfaktor for å utvikle sykdommen. Hvis man ikke blir smittet med EBV i tidlige barneår, men møter viruset først noe senere i livet, utvikler mer enn halvparten av de smittede infeksiøs mononukleose. Det å utvikle infeksiøs mononukleose øker i seg selv risikoen for å få MS omtrent to ganger (8).
Det er også flere epidemiologiske studier som tyder på at røyking øker sykdomsrisikoen nesten like mye (9). En studie viste også at det kan være en dose-respons-sammenheng for kumulativ røykedose (10).
Hvis man ser på utbredelsen av MS på verdensbasis, er det en tendens til at MS er hyppigere i områder som ligger lengre bort fra ekvator, der også sollysets intensitet er mindre (11). En hypotese som kan forklare dette er en mulig sammenheng mellom lave nivåer av vitamin D og risiko for å utvikle MS (12). Selv om en rekke studier støtter en slik sammenheng (13, 14), er det fortsatt ikke slått fast hvorvidt lave nivåer av vitamin D har en kausal rolle ved MS (15).
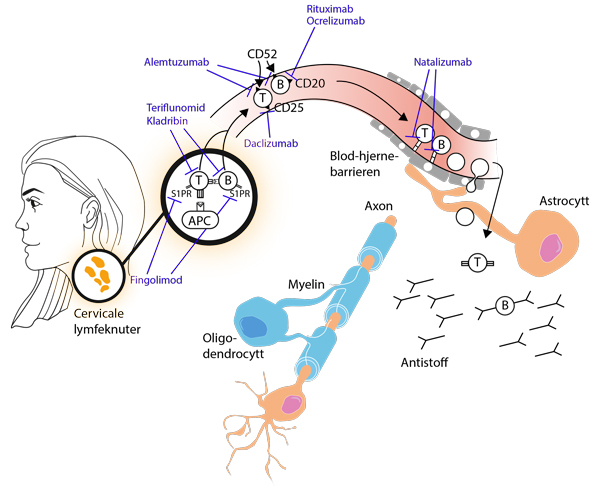
Hos pasienter med MS aktiveres T- og B-celler i sekundære lymfoide organer som i cervicale lymfeknuter. De aktiverte lymfocyttene fraktes med blodbanen og binder seg til endotelet i blod-hjerne-barrieren og krysser denne. I hjernen reaktiveres de og gjøre skade på myelin, oligodendrocytter og aksoner. Fingolimod er en sfingosin-1-fosfat-reseptor-antagonist som hindrer lymfocyttene i å forlate lymfeknutene. Natalizumab er et monoklonalt antistoff som binder seg til α4β1-integrinet på lymfocytter, blokkerer molekylære interaksjoner med endotelceller og dermed hindrer cellene i å passere over blod-hjerne-barrieren. Rituximab og ocrelizumab er monoklonale antistoff mot CD20-antigenet på overflaten av B-celler. Alemtuzumab er spesifikt for CF52-antigenet som finnes på overflaten av både T- og B-celler. Teriflunomid og kladribin hemmer DNA-syntesen i prolifererende lymfocytter, mens daclizumab er et monoklonalt antistoff spesifikt for CD25-molekylet som uttrykkes av aktiverte T-celler. Virkningsmekanismene til interferoner, glatirameracetat og dimetylfumarat er ikke fullstendig klarlagt, og disse er ikke med i figuren.
Ved MS finnes det avgrensede lesjoner i både hvit og grå substans i hjernen og ryggmargen (16). Tidligere trodde man at MS nesten utelukkende affiserte hvit substans, men det har etter hvert blitt klart at patologien i grå substans kan være like uttalt (17), og at den også kanskje korrelerer bedre med funksjonssvikten over tid (18). Lesjoner i hvit substans består typisk av perivaskulære infiltrater av aktiverte mikroglia, makrofager og lymfocytter (16). I disse lesjonene skjer det en demyelinisering, men det er også en uttalt grad av skade på selve aksonene (19). Ved langtkommen MS har man funnet ansamlinger av en type lymfocytter kalt B-celler i hjernehinnene (20). Noen studier har også vist at slike ansamlinger av B-celler er assosiert med lesjoner i den underliggende grå substansen (21).
Vi vet ikke sikkert om sykdoms-prosessen ved MS starter i sentralnervesystemet, og at infiltrasjonen av immunceller skjer som en konsekvens av dette, eller om immuncellene trigges andre steder i kroppen, for deretter å søke til hjernen og ryggmargen der de gjør skade. Den siste hypotesen er den som ansees som mest sannsynlig per i dag, og dette synet støttes av at behandling som er rettet mot immunsystemet ser ut til å være svært effektiv. Hvis sykdomsprosessen ved MS primært drives av immunsystemet, vil vi kunne forvente at pasienter som får adekvat behandling utvikler mindre grad av funksjonssvikt på lang sikt. Det finnes imidlertid ennå ikke nok data til at vi kan konkludere sikkert om dette.
Både T-celler og B-celler aktiveres i sekundære lymfoide organer, som lymfeknuter eller milt. Hjernens lymfesystem dreneres til dype cervicale lymfeknuter (22, 23), og det er vist at B-cellene i hjernen til MS-pasienter er beslektet med B-cellene som finnes i cervicale lymfeknuter (24). For å komme inn i hjernen må T-cellene og B-cellene forlate lymfeknutene, vandre med blodbanen og krysse blod-hjerne-barrieren. Immunmodulerende behandling ved MS i dag har ulike angrepspunkt for T- og B-celler på deres vandring til sentralnervesystemet. En illustrasjon av dette er gitt i figuren over.
Behandlingsprinsippet ved MS følger gjerne en trappetrinnmodell der en skiller mellom første-, annen- og tredjelinjebehandling. Selv om dette prinsippet for medikamentvalg kan være en nyttig rettesnor, vil det likevel være nødvendig å tilpasse behandlingen til pasientenes individuelle behov og ønsker, og det kan enkelte ganger være riktig å velge annen- eller tredjelinjepreparater med en gang.
Førstelinjepreparater ansees som relativt sikre, men vil være effektive hos bare en andel av pasientene. Interferoner, glatirameracetat, teriflunomid og dimetylfumarat regnes til denne gruppen, og de to siste er perorale behandlingsalternativ ved MS. Hos pasienter som viser tegn til sykdomsaktivitet til tross for denne behandlingen, gir man i stedet et annenlinjepreparat som natalizumab eller fingolimod. Natalizumab administreres intravenøst og fingolimod peroralt. En fryktet bivirkning ved langvarig bruk av natalizumab er progressiv multifokal leukoencefalopati (PML), som skyldes en reaktivering av polyomaviruset JC (JC-virus) i hjernen og rammer 4 av 1000 pasienter som er seropositive for dette viruset. Hvis pasienten er seropositiv for JC-virus, velges derfor gjerne fingolimod eller et annet preparat. Rituximab, et monoklonalt antistoff mot CD20-antigenet på B-celler, brukes også mye som et annenlinjepreparat i Sverige, til tross for at dette preparatet ikke er godkjent til bruk mot MS. En annen, mer humanisert utgave av anti-CD20-antistoffet, ocrelizumab, har nylig vist god effekt i fase 3-studier ved MS og vil sannsynligvis bli sluppet på markedet om ikke lenge. Andre medikamentelle alternativer som vil kunne bli tilgjengelige i løpet av få år er kladribin, en syntetisk purinanalog, og daclizumab, et monoklonalt antistoff mot CD25 på aktiverte T-celler.
Som tredjelinjebehandling regnes ofte alemtuzumab, et monoklonalt antistoff mot antigenet CD52, som finnes på overflaten av både T- og B-celler. Fordelen med dette medikamentet er at det gis som induksjonsbehandling, det vil si at behandlingen gis over en uke, og deretter på nytt først ett år etter første behandlingssyklus. Ulempen er at om lag en tredjedel av pasientene utvikler sekundære autoimmune sykdommer. Selv om det oftest dreier seg om autoimmun tyroidealidelse, er det også beskrevet tilfeller med immunologisk trombocytopeni og Goodpasture syndrom. Autolog hematopoetisk stamcelletransplantasjon har vist svært lovende resultater i fase 2-studier, men mange etter-lyser randomiserte kontrollerte studier der denne behandlingen sammenliknes med noen av de mest effektive medikamentene (25).
Immunmodulerende behandling er effektivt ved attakkpreget MS, kjent som ”relapsing-remitting MS”, men ser ut til å ha dårlig effekt ved primær og sekundær progressiv MS. Nylig har imidlertid to fase 3-studier vist lovende resultater for biotin (26) og ocrelizumab (27). For ocrelizumab spekuleres det på om effekten ved primær progressiv MS gjelder en undergruppe av pasientene som har påvisbar betennelse i sentralnervesystemet.
Referanser