Parallelt med en kraftig økning av antall personer med fedme i Norge og verden forøvrig har forekomsten av type 2 diabetes økt. Pasienter med fedme og type 2 diabetes har økt risiko for mikro- og makrovaskulære komplikasjoner, og behandlingen bør tilstrebe å minimere denne risikoen.
Diabetes mellitus diagnostiseres i dag ved HbA1c ≥ 6,5 %, eventuelt ved plasma/serum glukose ≥ 7,0 mmol/l ved faste og/eller ≥ 11,1 mmol/l to timer etter oralt inntak av 75 g glukose. De diagnostiske grensene sammenfaller med de antatte knekkpunktene for når risikoen for retinopati øker betydelig. Grenseverdiene er omdiskuterte og delvis arbitrære. På tross av dette definerer grensene en gruppe personer med økt risiko for prematur død og økt risiko for mikro og makrovaskulære sykdommer.
Type 1 diabetes er en autoimmun sykdom, mens årsaken til type 2 diabetes er multifaktoriell. Alder, arv og vekt er de viktigste risikofaktorene for type 2 diabetes. Omkring 80-90 % av alle med type 2 diabetes har overvekt [kroppsmasseindeks (KMI) 25-29,9 kg/ m2] eller fedme (KMI ≥ 30 kg/m2). Fedmeepidemien som har feid over verden de siste 20-30 årene har dermed også resultert i en diabetesepidemi. En av elleve voksne har diabetes i verden i dag. Antallet er forventet å stige fra 415 millioner i dag til 642 millioner innen 2040 (1). Norge er ikke noe unntak, og forekomsten av både fedme og diabetes har økt de siste tiårene. Helseundersøkelsen i Nord-Trøndelag har vist at prevalensen av fedme hos voksne har økt, og omkring hver femte kvinne og mann antas nå å ha fedme (2). Samtidig er forekomsten av type 2 diabetes stigende, og omkring 4 % av Norges befolkning antas nå å ha type 2 diabetes (3).
Fedme og spesielt sentral fedme medfører insulinresistens. Det betyr at insulin produsert i bukspyttkjertelens beta-celler virker dårligere i målcellene i fettvev, muskulatur og lever. En viktig oppgave for leveren er å produsere glukose når vi ikke spiser (for eksempel om natten) for å opprettholde stabile glukoseverdier. Det er en sammenheng leversteatose og grad av insulinresistens i leveren (4). Hyperglykemi oppstår først når bukspyttkjertelens insulinproduserende celler ikke evner å produsere nok insulin for å tilfredsstille kroppens behov. Siden personer med fedme ofte har leversteatose og dermed insulinresistens i leveren, vil disse personene typisk ha fastende hyperglykemi (5). En studie har for eksempel vist at fire av fem pasienter med sykelig overvekt og diabetes ble diagnostiser ved fastende hyperglykemi (6). Dette er i kontrast til eldre og slanke personer som oftest har postprandial hyperglykemi på grunn av svekket beta-cellefunksjon.
Ved behandling av type 2 diabetes og samtidig fedme bør vektreduksjon gjennom kostendringer og økt fysisk aktivitet vektlegges. Pasienten bør gis nødvendig informasjon og kunnskap om hvilke endringer som er nødvendig. Behandler bør forsøke å skape et eget ønske for endring hos pasienten gjennom motiverende intervjuteknikk. Norske retningslinjer anbefaler at alle pasienter med type 2 og overvekt eller fedme bør få tilbud om et strukturert livsstilsbehandlingsprogram med minst seks måneders varighet (7). Selv moderat vektreduksjon på 5-10 % kan gi betydelig bedret glykemisk kontroll (8).
Ved medikamentell behandling bør norske anbefalinger følges (Figur 1). Metformin er førstevalget og vil hos de fleste med overvekt ha god effekt da medikamentet bedrer leverens insulinfølsomhet og reduserer dermed leverens glukoseproduksjon. Ved behov for flere medikamenter kan det være gunstig å velge medikamenter som ikke samtidig medfører vektøkning. Dipeptidylpeptidase-4 (DPP-4) hemmere er vektnøytrale og har vist seg å være sikre i flere studier. Glukagonlignende peptid-1 (GLP-1)-analog som stimulerer beta-cellene til økt insulinproduksjon, og hemmere av natriumglukose-kotransportør 2 (SGLT2) som øker utskillelsen av glukose via nyrene, gir begge lett vektreduksjon. Enkelte av disse medikamentene (liraglutide, semaglutide og empagliflozin) er også vist å redusere forekomsten av kardiovaskulære hendelser (9, 10, 11). Ved behov for insulinbehandling bør middels langtidsvirkende insulin satt på kvelden forsøkes først. Dette vil hemme endogen glukoseproduksjon fra leveren om natten og dermed gi lavere blodsukker om morgenen. Behandling av hyperglykemi reduserer risikoen for mikro- og makrovaskulære komplikasjoner og død (12). Diabetes varighet og grad av hyperglykemi er avgjørende for utvikling av diabetiske komplikasjoner. Personer som har fedme kan få diabetes i relativt ung alder. Det er derfor viktig å behandle disse pasientene aggressivt fra første stund. Initialt kan diabetesen være lett å behandle, og i denne fasen kan nært normalt blodsukker (HbA1c < 6,5 %) være et passende behandlingsmål.
For å minimere risikoen for vaskulære komplikasjoner, skal dyslipidemi og høyt blodtrykk behandles liberalt (7). Alle over 40 år med LDL-kolesterol over 2,5 mmol/l bør behandles med kolesterolsenkende medikamenter. Videre bør pasienter med diabetes og blodtrykk over 140/90 mmHg behandles med blodtrykkssenkende medikamenter. Ved samtidig mikroalbuminuri er ACE-hemmere eller angiotensin II-reseptorantagonister anbefalte blodtrykksmedikamenter.
Pasienter med sykelig overvekt (KMI ≥ 40 kg/m2 eller KMI ≥ 35 kg/m2 med en eller flere fedmerelaterte sykdommer som type 2 diabetes, hypertensjon eller søvnapné) kan kvalifisere for fedmekirurgi. De to vanligste operasjonstypene i verden og i Norge i dag er gastrisk bypass og sleeve-gastrektomi (Figur 2). Det er rapportert svært lav dødelighet og få alvorlige komplikasjoner ved denne type inngrep (13). Operasjonene er likevel ikke uten betydelige negative konsekvenser. Flere kan få ubehag ved matinntak, flere får kroniske magesmerter og vitamin- og mineralmangler er vanlige dersom pasienten ikke tar tilskudd. Fedmekirurgi medfører betydelig (omkring 30 %) og som oftest relativ varig vekttap (14). Dette resulterer i bedret metabolsk kontroll. På kort sikt blir omkring to av tre med diabetes og en av to med hypertensjon kvitt sine sykdommer (8). Dessverre kommer tilstandene tilbake i mange tilfeller etter hvert som vekten går noe opp igjen og pasientene blir eldre. De metabolske effektene av fedmekirurgi er overlegne alle medisinske behandlinger og er sannsynligvis forbundet med redusert dødelighet (15). Det er samtidig viktig å understreke at det i motsetning til enkelte medikamentstudier, ikke er utført randomiserte kontrollerte fedmekirurgiske studier på pasienter med type 2 diabetes som har vist redusere forekomsten av kardiovaskulære hendelser og død.
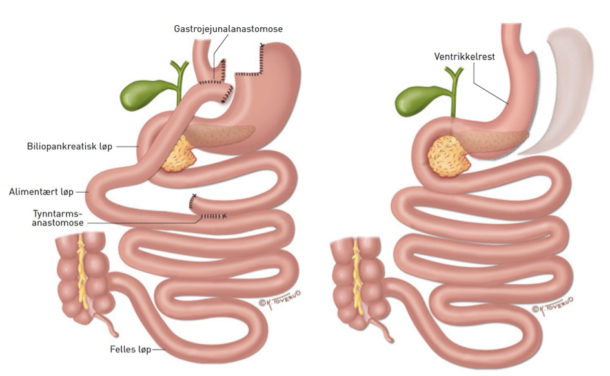
Figur 2. Illustrasjon av gastric bypass til venstre og gastrisk sleeve (ventrikkelreseksjon) til høyre.
Fra Hofsø et al. Tidsskr Nor Legeforen 2011 (gjengitt med tillatelse fra Kari C. Toverud).
Fedmekirurgi har også vist seg å gi bedre glykemisk kontroll hos pasienter med type 2 diabetes med KMI < 35 kg/m2 og utenlandske og norske diabetesretningslinjer åpner nå også opp for fedmekirurgi ved KMI 30,0-34,9 kg/m2. Nasjonale retningslinjer anbefaler at fedmekirurgi til denne pasientgruppen kun bør tilbys etter en grundig utredning og vurdering av et tverrfaglig team med spesiell ekspertise på vektreduserende kirurgi (7). Det er i dag ikke avklart hvilken operasjonstype som bør tilbys pasienter med fedme og type 2 diabetes. En randomisert kontrollert studie tyder dog på noe bedre effekt av gastrisk bypass enn sleeve-gastrektomi (16), men forskjellen var i denne studien liten. En pågående studie (Osebergstudien) ved Senter for sykelig overvekt i Helse Sør-øst ved Sykehuset i Vestfold vil forhåpentligvis gi ytterligere svar i løpet av 2019.
Fedme reduserer følsomheten for insulin i fettvev, muskulatur og lever og øker risikoen for utvikling type 2 diabetes betydelig. Vektreduksjon vil motvirke dette og er derfor viktig i behandlingen av hyperglykemi ved fedme. I enkelte tilfeller kan fedmekirurgi være et godt alternativ. Metformin er som for andre med type 2 diabetes, førstevalg ved medikamentell behandling. Ved behov for flere medikamenter kan den være fornuftig å velge medikamenter som er vektnøytrale eller gir en liten vektreduksjon. Pasientgruppen har betydelig økt risiko for mikro- og makrovaskulære komplikasjoner, og det er viktig med god blodtrykksbehandling. De fleste trenger også kolesterolsenkende behandling.
Referanser