Til tross for at man de senere år har tatt i bruk en rekke steroidsparende medikamenter, spiller glukokortikoider fortsatt en viktig rolle i behandlingen av inflammatoriske tilstander. Med behandlingen følger en rekke bivirkninger, deriblant glukokortikoid-indusert osteoporose. I denne artikkelen tar vi for oss retningslinjene fra American College of Rheumatology (ACR) og sammenligner dem kort med norske veiledere.
Antall personer som bruker glukokortikoider over tid er vanskelig å anslå. Tall fra reseptregisteret viser at det i 2017 i gjennomsnitt ble brukt 19 definerte døgndoser (10 mg) prednisolon per 1000 innbyggere per dag i Norge (1). I alt tar årlig omlag 240 000 personer ut resept på et systemisk glukokortikoid. Dette er i overenstemmelse med data fra USA som viser at ca. 1 % av befolkningen behandles med glukokortikoider til en hver tid (2). Mindre enn 1/3 av disse blir undersøkt med tanke på osteoporoseutvikling. Flere studier har vist at risikoen for hoftebrudd er 1,6 ganger høyere enn i bakgrunnsbefolkningen, og risikoen for vertebrale brudd er 2,6 ganger høyere (3, 4) Mer enn 10 % av pasienter som behandles med glukokortikoider over lengre tid får et klinisk brudd under behandlingen. Beintapet er størst de første 3-6 månedene av glukokortikoid-behandlingen (5, 6). Det er derfor viktig at man tidlig tar stilling til behov for profylaktiske tiltak mot bentap (7, 8). Kunnskapsgrunn-laget for medikamentell forebygging av glukokortikoid-indusert osteporose (GIOP) er mangelfull.
Benremodellering er en dynamisk prosess som involverer osteoklaster som absorberer ben, osteoblaster som har som hovedoppgave å danne nytt ben, og osteocytter. Dette nettverket av celler kommuniserer med hverandre for å opprettholde benhomeostase. Kommunikasjons-prosessen involverer en rekke vekstfaktorer, cytokiner, reseptor aktivator av nukleær faktor kappa-B ligand (RANKL) og osteoprotegrin som er produsert lokalt av osteoblaster og osteocytter for regulering av osteoklastogenese. Faktorer som blir frigjort fra osteocytter og fra osteoklaster under benresorpsjon kontrollerer osteoblastutvikling og funksjon (7).
Effekten av glukokortikoider på benremodelleringsprosessen skjer både direkte og indirekte og involverer en rekke signalveier. Glukokortikoider øker RANK-ligand og reduserer osteoprotegrin fra osteoblastene. Dette fører til forlenget levetid for osteklaster og redusert levetid for osteoblaster, altså en forskyvning mot mer benabsorbsjon fremfor benformasjon. Samtidig er glukokortikoider assosiert med redusert levetid for osteocyttene, og fører dermed til redusert benformasjon via redusert aktivitet av flere vekstfaktorer, deriblant insulin-like growth factor-1 (IGF-1). Redusert IGF-1-aktivitet bremser osteoblastdifferensieringen. I tillegg induserer glukokortikoider via adipogenic transcription factors (PPARy) til rekruttering av adipocytter fremfor preosteoblaster. Wnt-signaliserings proteinet som er essensielt for benremodelleringen via flere signalveier, som vi ikke går nærmere inn på her, får redusert funksjon under glukokortikoidpåvirkning
(7, 9). Glukokortikoider forårsaker i tillegg til bentap via en hemning av østrogen, testosteron og binyreandrogener, som fører til økt osteoklastfunksjon (9).
Kalsium-metabolismen affiseres også direkte av glukokortikoider. Gastrointestinal absorpsjon av kalsium reduseres, og renalt kalsiumtap øker (10). Det er imidlertid ingen bevis for forhøyede endogene nivåer av PTH i disse pasientene. Den negative effekten på benremodelleringen skjer umiddelbart etter oppstart med glukokortikoider.
American College of Rheumatology (ACR) anbefaler at man vurderer bruddrisiko så tidlig som mulig, og helst innen seks måneder etter oppstart med glukokortikoider.
De deler glukokortikoidbehandling inn i to kategorier:
1)lav dose som tilsvarer prednisolon <7,5 mg/dag og
2)høy dose som tilsvarer prednisolon ≥7,5 mg/dag.
Både høye daglige doser og høye kumulative doser øker risikoen for brudd. Glukokortikoider har større effekt på trabekulært bein enn kortikalt bein, og risikoen for vertebrale brudd øker dermed relativt mer enn risikoen for brudd i rørknokler (8).
Benmineraltetthet (BMD) er den sterkeste målbare prediktoren for osteoporotiske brudd generelt. Risikoen for brudd ved en gitt BMD antas å være høyere hos pasienter som behandles med glukokortikoider enn i bakgrunnsbefolkning (11). BMD ved behandlingsstart og graden av tap av beinmasse under behandling er viktige prediktorer for utvikling av brudd ved GIOP. BMD måles med (dobbel røntgenabsorbsjonsmetri) DXA, og svar gis som regel som antall standard deviasjoner fra en ung, frisk voksenpopulasjon (T-score). WHO definerer osteoporose som en T-score ≤-2,5. For personer <40 år sammenligner man BMD med friske på samme alder (Z-score).
For pasienter som skal bruke glukokortikoider i minst tre måneder anbefaler ACR ingen BMD-måling hos voksne <40 år uten risikofaktorer. Hos voksne <40 år med tidligere osteoporotiske brudd eller andre risikofaktorer, og hos voksne ≥40 år anbefales BMD-måling innen seks måneder etter oppstart med glukokortikoider (8).
Bruddrisikoen er multifaktoriell. I tillegg til BMD og glukokortikoid-dose må man ta hensyn til demografiske faktorer som alder, kjønn og livsstilsfaktorer. Risikokalkulatorer kan brukes som veileder i klinikken. Den mest brukte internasjonalt er FRAX® (12). Prinsippet for bruk av kalkulatoren for å beregne bruddrisiko kan minne om bruk av Framingham risk score for beregning av kardiovaskulær risiko. Kalkulatoren oppgir samlet risiko for osteoporotiske brudd og risiko for hoftebrudd i løpet av en 10-års periode. Faktorene som inngår i kalkulatoren er skrevet i kursiv i Figur 1. Ved bruk av prednisolon ≥7,5 mg daglig er risiko for osteoporotiske brudd beregnet med FRAX 1,15 ganger høyere enn for ikke glukokortikoidbrukere, og risikoen for hoftebrudd 1,2 ganger høyere. FRAX® risikokalkulator foreligger også i en versjon tilpasset bruddrisiko i Norge (13).
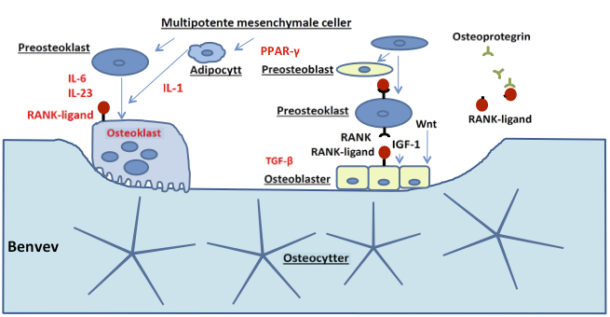
Figur 1: Forenklet modell av benremodelleringsprosessen med hovedvekt på signalveier som påvirkes av glukokortikoider. Faktorer som fører til benabsorbsjon / bremser nydannelse i rød skrift.
Det er ikke utviklet prediksjonsverktøy for voksne <40 års alder. Ikke desto mindre viser observasjonsdata en 10 års risiko på 5-10 % for klinisk diagnostisert vertebrale brudd blant premenopausale kvinner ≥30 år som får glukokortikoid-doser tilsvarende ≥ 30 mg prednisolon daglig (8). Anbefalingene for denne gruppen bygger i stor grad på konsensus, og i klinisk praksis blir individuell vurdering viktig.
En viktig faktor når det gjelder vurdering av bruddrisiko under glukokortikoid-bruk, er at grunntilstanden i seg selv ofte innebærer økt risiko for osteoporose. Forhøyede inflammatoriske markører, inklusivt CRP, er assosiert med økt bruddrisiko, og høy sykdomsaktivitet er assosiert med lav BMD. Eksempelvis har pasienter med reumatoid artritt, sammenlignet med en frisk bakgrunnsbefolkning, doblet risiko for hofte- og vertebrale brudd, uavhengig av bruk av glukokortikoider (14).
I retningslinjene fra American College of Rheumatology, har forfatterne delt inn i tre bruddrisiko kategorier som grunnlag for å avgjøre hvem som skal tilbys medikamentell bruddforebygging (tabell 1). Risikovurderingen for voksne ≥40 år bygger i stor grad på FRAX, som er relativt lite brukt i Norge i klinisk praksis.
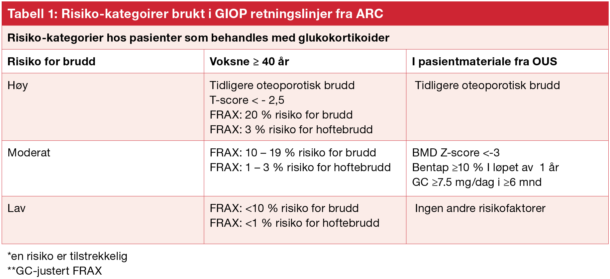
Tabell 1: Risiko-kategoirer brukt i GIOP retningslinjer fra ARC
Anbefalingene gitt av American College of Rheumatology (ACR) er GRADE-baserte og ble publisert i august 2017 (8). Det understrekes at ingen av studiene som anbefalingene bygger på har vært designet med brudd som primært endepunkt.
Det er også viktig å ta med i betraktning at glukokortikoider er en potensiell reversibel risikofaktor for steroid-indusert osteoporose. Hvis glukokortikoid-behandlingen avsluttes, vil BMD øke og risikoen avta (5).
I tillegg til ikke-medikamentelle tiltak mot risikofaktorene nevnt i figur 1 og tiltak for å redusere glukokortikoid-dosen, anbefaler ACR at pasienter som skal bruke doser tilsvarende prednisolon ≥2,5 mg over tre måneder bør ha et daglig kalsiuminntak på 1200 mg og vitamin D-inntak på 800 IE. For de aller fleste vil man anbefale tilskudd for å sikre tilstrekkelig inntak.
Medikamentell osteoporosebehandling har som mål å forebygge brudd. Virkningsmekanismene kan grovt deles inn i anabole og antiresorptive mekanismer. Teriparatid (Forsteo®) er for tiden det eneste anabole middelet som er markedsført i Norge. Medikamentet stimulerer til bendannelse ved direkte påvirkning av osteoblaster. Osteoblastene øker indirekte tarmabsorpsjonen av kalsium og den tubulære kalsium-reabsorpsjonen i tillegg til fosfat-utskillelsen av i nyrene. Studier har vist signifikant reduksjon av vertebrale brudd hos kvinner med osteoporose (15). Medikamentet dekkes ikke av blåreseptordningen, men det kan søkes individuell refusjon for pasienter med alvorlig osteoporose, det vil si T-score ≤ -3,5, mange brudd (3 eller flere ryggbrudd på diagnosetidspunkt) eller alvorlige ryggbrudd med mer enn > 40 % kompresjon. Selv om det ikke er gjort studier i GIOP med brudd som primært endepunkt, foreslår flere forfattere ut i fra effekten på BMD, subgruppeanalyser og metaanalyser, teriparatid som det foretrukne medikamentet etter alendronat i behandling av GIOP (16, 17). Medikamentet gis som daglige subkutane injeksjoner og behandlingstiden bør av sikkerhetshensyn være maksimalt 24 måneder. Det er viktig med umiddelbar overgang til et antiresorptivt medikament dersom behandlingen med glukokortikoider kontinueres og risiko for brudd fortsatt er høy.
SERM, selektive østrogen reseptor modulatorer, har kun vist effekt på reduksjon i forekomsten av vertebral brudd hos postmenopausale osteoporotiske kvinner. Medikamentgruppen er i liten grad prøvd ut ved GIOP. SERM ansees kun å være aktuell behandling hos et fåtall på grunn av usikker effekt ved GIOP og risikoen for kardiovaskulære og tromboemboliske bivirkninger (8). Østrogener inngår ikke i anbefalingene for forebygging og behandling av GIOP av samme risiko-nytte-vurderinger som nevnt for SERM.
Bisfosfonatene har en hemmende virkning på osteoklastene og hemmer dermed benresorpsjonen uten direkte effekt på bendannelsen. Medikamentet reduserer signifikant bruddforekomsten i en osteoporotisk populasjon (18). Bisfosfonater binder seg til benvev, og har vist å kunne beskytte mot brudd, også etter avbrutt behandling. De perorale alternativene er førstelinje-behandling ved postmenopausal osteoporose og GIOP, mens de intravenøse anbefales ved gastrointestinale bivirkninger eller manglende evne til å sitte oppreist og være fastende 1/2 time etter inntak av tablettene (8). En Cochrane-analyse av 12 studier med tilsammen 1343 deltakere konkluderer med at 31 personer (range 20-145) på glukokortikoider må behandles med bisfosfonat for å forebygge ett vertebralt brudd. Tilsvarende tall for forebygging av ikke-vertebralt brudd er 42 (range 25 -69) (19). Svært sjeldne bivirkninger ved langtidsbehandling med bisfosfonater er osteonekrose i kjeven og atypiske femur frakturer. Osteonekrose i kjeven sees i hovedsak hos pasienter med malign sykdom. I en retrospektiv studie fra Mayo-klinikken blant kreftpasienter som fikk intravenøst bisfosfonat fant man tilstanden hos 0,42 % av pasientene (20). Forfatterne konkluderer med at nytten ved bruddforebygging oppveier denne risikoen. Atypisk femurfrakturer er likeledes sjelden. I en svensk retrospektiv studie fant man at risikoen for atypisk femur fraktur var 11 per 10 000 pasientår på bisfosfonat (21). Risikoen ble redusert med 70 % per år etter seponering av bisfosfonater.
Denosumab bindes til RANKL og hemmer dermed osteoklastfunksjonen . Medikamentet har vist bruddforebyggende effekt i studier (22). Det er lite evidens for bruddforebyggende effekt ved GIOP, og i retningslinjene fra ACR uttrykkes bekymring over uklare immunologiske konsekvenser hos pasienter som står på immunsuppresiva (8). Likeledes betraktes SERM kun å være aktuell behandling hos et fåtall på grunn av usikker effekt ved GIOP og risikoen for kardiovaskulære og tromboemboliske bivirkninger (8). Mest brukt er raloksifen, (Evista®). Østrogener inngår ikke i anbefalingene for forebygging og behandling av GIOP av samme risiko-nytte-vurderinger som nevnt for SERM.
I de aller fleste tilfeller hvor det er behandlingsindikasjon, er peroralt bisfosfonat første valg (Tabell 2). For voksne >40 år som har kontraindikasjoner mot, eller får bivirkninger av perorale bisfosfonater, anbefaler ACR intravenøse bisfosfonater fremfor kun behandling med kalsium og vitamin D. Hvis bisfosfonatbehandling ikke er hensiktsmessig, anbefales teriparatid. Denosumab nevnes som siste valg på grunn av manglende resultater fra studier på GIOP. Ordinær østrogenbehandling anbefales ikke. SERM anbefales kun til postmenopausale kvinner som har kontraindikasjoner mot- eller har fått bivirkninger av annen behandling.
For kvinner i fertil alder som har moderat til høy risiko for fraktur og ikke planlegger å bli gravid under osteoporosebehandling og bruker effektiv prevensjon, anbefales peroralt bisfosfonat i tillegg til kalsium og vitamin D. Teriparatid er 2. valg. Denosumab og intravenøse bisfosfonater skal kun startes etter en nøye risikovurdering.
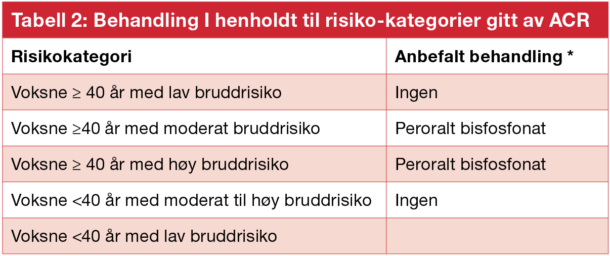
Tabell 2: Behandling I henholdt til risiko-kategorier gitt av ACR
ACR anbefaler at alle som behandles med glukokortikoider får en klinisk vurdering av bruddrisiko årlig (6). DXA-kontroller anbefales hvert 2. – 3. år hos voksne ≥40 år som står på glukokortikoider og har brukt eller fortsatt bruker osteoporosemedikamenter. Voksne ≥40 år som står på glukokortikoider som aldri har brukt osteoporosemedikamenter anbefales DXA hvert 1. – 3. år. Voksne < 40 år som bruker glukokortikoider og har moderat til høy bruddrisiko, anbefales BMD testing hvert 2.-3. år.
Voksne ≥40 år som har blitt behandlet med perorale bisfosfonater og kontinuerer glukokortikoidbehandling og har moderat til høy risiko for fraktur ved kontroll, anbefales å fortsette osteoporosebehandling. ACR retningslinjene foreslår at man fortsetter med perorale bisfosfonater i 7-10 år. Behandlingen bør imidlertid avbrytes om pasienten på grunn av økning i BMD ikke lenger vurderes å være i moderat til høy risiko for brudd.
Voksne ≥40 år som er behandlet med osteoporosemedikamenter anbefales å seponere disse hvis frakturrisiko er estimert til å være lav ved behandlingsslutt. Ellers er det anbefalt å kontinuere behandlingen med osteoporosemedikamenter til bruddrisiko er lav.
Terapisvikt defineres i de fleste veiledere som brudd oppstått minst 18 måneder etter oppstart med peroralt bisfosfonat eller en signifikant nedgang i BMD (≥10 % per år) etter 1 års behandling (8). Voksne ≥40 år som fortsatt bruker glukokortikoider og opplever terapisvikt, anbefales intravenøst bisfosfonat eller en annen klasse av medikamenter; teriparatid eller denosumab.
Det er ikke utarbeidet nasjonale kunnskapsbaserte retningslinjer for osteoporose. Norsk endokrinologisk forening har i sin veileder kun en kort kommentar til GIOP i det generelle osteoporose-kapittelet. De anbefaler tilskudd av kalk og D-vitamin ved bruk av glukokortikoider over 3 måneder og angir en prednisolon-dose på ≥5 mg daglig som grense for oppstart av medikamentell behandling (23). Norsk revmatologisk forenings prosedyre (24) anbefaler medikamentell behandling ved prednisolon doser ≥7,5 mg daglig, og økt risiko for brudd. Postmenopausale kvinner med T-score ≤-1 nevnes spesielt, mens det for vurdering av andre risikofaktorer henvises til internasjonale retningslinjer” (fra: Norsk revmatologisk forenings prosedyre (24) anbefaler medikamentell behandling ved prednisolon doser ≥7,5 mg daglig, og økt risiko for brudd. Postmenopausale kvinner med T-score ≤-1 nevnes spesielt, mens det for vurdering av andre risikofaktorer henvises til internasjonale retningslinjer.
For å redusere forekomsten av glukokortikoidindusert osteoporose, er det viktig med en vurdering av bruddrisiko så tidlig som mulig etter oppstart med glukokortikoider. Ved planlagt bruk av glukokortikoider ≥ 3 måneder, bør det gis tilskudd av kalk og D-vitamin til alle. I tillegg anbefales peroralt bisfosfonat (alendronat) dersom prednisolon-ekvivalent-dose er minst 5 – 7,5 mg daglig, og det er økt risiko for brudd. Ved terapisvikt eller intoleranse er kunnskapsgrunnlaget for mangelfullt til å gi sterke føringer for andrevalg av medikamenter, og individuelle hensyn vil spille en stor rolle.

Faktorer som bør vurdere i den totale risikovurderingen