Vårt moderne samfunn er preget av kalorioverskudd. Insulinresistens kan sees på som enkeltcellens forsvar mot metabolsk overbelastning, og kronisk opphopning av glukose, lipider og frie fettsyrer i systemisk sirkulasjon resulterer i den tilstanden vi har valgt å kalle «type 2-diabetes».
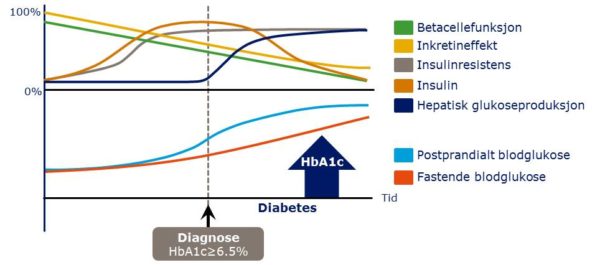
Figur 1. Gradvis utvikling av type 2-diabetes. Insulinresistens indusert av kalori-forgiftning inntreffer lenge før man får diagnosen type 2-diabetes. Betacelledysfunksjon markerer overgangen til mer alvorlig metabolsk sykdom. Basert på Kendall DM et al. Am J Med 2009:122(6 Suppl):S37–S50
Konsekvensen av det moderne samfunn er at mennesket, homo sapiens, for første gang har ubegrenset tilgang på kalorier, gjerne i prosessert og konsentrert form, og at det krever minimalt med anstrengelse å anskaffe seg disse kaloriene. Videre kan man leve et sedat liv uten ytre farer eller arbeid som forbruker vesentlig energi.
Denne situasjonen har riktignok gjort homo sapiens til jordklodens mest tallrike og lengstlevende pattedyr, med evne til å bebo de mest avsidesliggende regioner, hvor få andre kan overleve, og rikelig med tid til overs som kan benyttes på andre sysler, som vitenskap, kunst og kultur. En suksesshistorie uten sidestykke med andre ord. Et problem er dog at vi aldri tidligere har opplevd denne situasjonen gjennom vår evolusjonsmessige historie, snarere det motsatte, og at det biokjemiske maskineri som utfører vår metabolisme ikke er forberedt på tilstanden. Med ubegrenset tilgang på kalorier, og en sedat livsstil, vil kroppens fettvev ekspandere, vi blir overvektige og fete, hvilket i utgangspunktet er en ønsket tilstand, ettersom dette er opplagsnæring som kan brukes i magrere tider. Problemet oppstår når de magrere tidene aldri kommer, og kroppen ikke lenger makter å lagre overskuddsenergien på en forsvarlig måte. Denne motsetningen mellom hva våre gener er selektert til å håndtere, og livsvilkårene i det moderne samfunnet, gir opphav til økende grad av metabolske utfordringer. Karakteristisk er at stadig økende nivåer av glukose, lipider og frie fettsyrer opptrer i systemisk sirkulasjon, som har toksiske effekter på kroppens celler og vev, såkalt glukotoksisitet og lipotoksisitet, altså en kaloriforgiftet tilstand. Dette manifesterer seg til slutt som sykdommen som vi har valgt å kalle type 2-diabetes. Denne sykdommen diagnostiseres relativt arbitrært når systemisk opphopning av glukose har kommet til et visst nivå, f.eks. langtidsblodglukose, HbA1c≥6.5%.
Insulinresistens er et fenomen karakterisert av nedsatt følsomhet for insulin i lever, muskulatur og fettvev, og dermed redusert opptak av glukose, fett og aminosyrer i disse vevene. Insulinresistens er dels arvelig betinget, men øker ved kronisk kalorioverskudd, og er en medvirkende årsak til sykdomsutviklingen av type 2-diabetes (1). Samtidig er insulinresistens ikke utelukkende en patologisk tilstand. Under graviditet, sykdom, pubertet ser man induksjon av insulinresistens, antagelig som en mekanisme for å prioritere energi til henholdsvis fosteret, immunforsvaret og hjernens utvikling. Faktisk møter kroppen et energioverskudd etter hvert måltid i form av postprandiale økninger i glukose, lipider og aminosyrer. Dette håndteres gjennom utskillelse av insulin, men også midlertidig insulinresistens i skjelett- og hjertemuskulatur, hvilket favoriserer energilagring i fettvev til senere bruk. Insulinresistens kan altså sees på som en dynamisk prosess som justeres individuelt i ulike organer for effektiv fordeling av energi til ulike formål (2-4).
I motsetning til uregulert type 1-diabetes hvor cellene er insulinfølsomme, men sulter på grunn av insulinmangel, opplever cellene ved type 2-diabetes kronisk energioverskudd. I et slikt perspektiv kan insulinresistens anses som en forsvarsmekanisme mot kaloriforgiftning, og en ønsket respons fra kritiske organer med formål om å beskytte seg mot metabolsk overbelastning. Dette gjelder særskilt hjertemuskulatur som er sårbar overfor næringsindusert dysfunksjon (5 – 9). Problemet er at næringsstoffene da hoper seg opp systemisk, eller deponeres ektopisk utenfor fettvev, f.eks. som visceral fedme. Ektopisk fettlagring i bukspyttkjertelen står sentralt i patogenesen til type 2-diabetes (10). Visceralt inflammert adiposevev er forbundet med ytterligere insulinresistens, hvilket legger enda større press på betacellene. Insulinresistens og sviktende betacellefunksjon danner dermed en ond sirkel så lenge kaloritilgangen opprettholdes, og resultatet er en gradvis forverring av den metabolske tilstanden.
Det er vist at nedsatt insulin-følsomhet og hyperinsulinemi kan induseres i løpet av kun en måneds overspising (40% hyperkalorisk diett) hos friske normalvektige personer, og dette skjer innenfor normal BMI. Tilstanden er reversibel med påfølgende kalorirestriksjon (4). Skjelettmuskulatur står for 80% av insulinindusert glukoseopptak i perifere vev og fysisk inaktivitet øker insulinresistensen. En ukes sengeleie induserer omlag 30% nedsatt insulinfølsomhet hos friske forsøkspersoner (11). Insulinresistens induseres altså mange år før man får diagnosen type 2-diabetes, og før man har utviklet fedme. Når kalorioverskuddet blir kronisk, og får pågå over mange år kan resultatet bli type 2-diabetes. I et slikt perspektiv er kanskje type 2-diabetes prisen kroppen må betale for overlevelse i en kaloriforgiftet tilstand.
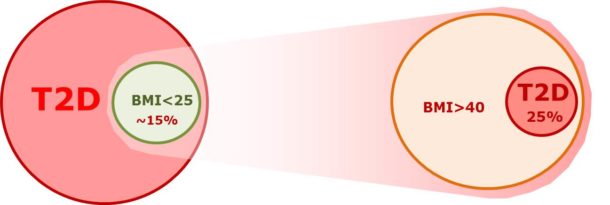
Figur 2. Metabolsk risiko avhenger av evne til å lagre kalorioverskudd i subkutant fett. Kun 25% av personer med BMI>40 har type 2-diabetes, mens 15% av personer med type 2-diabetes har BMI<25 (12).
Kronisk kalorioverskudd induserer fedme, men selv om fedme er prevalent hos personer med type 2-diabetes, utvikler kun et mindretall av overvektige personer diabetes. Det er med andre ord ikke fettet i seg selv som nødvendigvis forårsaker metabolsk sykdom. Dette beror på evnen til å lagre overskuddskaloriene i relativt sunt subkutant fett. Enkelte har betydelig evne til å lagre energi i subkutant fettvev, og kan ha høy BMI med normalt blodsukker. Faktisk har kun 25 % av personer med BMI >40 kg/m2 type 2-diabetes (12). Andre har lavere evne til subkutan fettlagring og vil utvikle metabolsk sykdom ved lavere BMI. Omkring 15 % av personer med type 2-diabetes har BMI <25 kg/m2 (12). Hvis man hemmer evnen til subkutan fettlagring hos forsøksdyr, vil de utvikle type 2-diabetes raskere, til tross for lavere kroppsvekt (13). Genetiske studier har også pekt på subkutan fettlagringskapasitet som sentral i risikoen for utvikle type 2-diabetes (14, 15). Det er ukjent hvorfor det er så stor variasjon i evnen til å lagre kalorioverskudd i subkutant fettvev, men noen hypoteser finnes (16).
Så lenge betacellene i pankreas klarer å øke insulinproduksjon vil normoglykemi opprettholdes, selv ved alvorlig insulinresistens. Først når betacellefunksjonen svikter, hvilket den gjør progressivt ved type 2-diabetes, blir resultatet hyperglykemi. Det er langt på vei ukjent hvorfor noen personers betaceller svikter lettere enn andres. Betacellenes problem er at de har en ´Urias post´ ved kronisk kalorioverskudd, fordi de både er satt til å monitorere blodsukkeret, og samtidig respondere på det ved insulinutskillelse. Når dette insulinet ikke lenger har den tilsiktede effekten på grunn av insulinresistens blir oppgaven uoverkommelig. En konsekvens av dette er at betacellene nedlegger arbeidet, såkalt betacelledysfunksjon. En hypotese er at heller ikke denne dysfunksjonen er en «defekt» ved type 2-diabetes, men snarere et forsøk fra betacellenes side på å beskytte seg selv mot fullstendig kaloriforgiftet destruksjon, slik at en viss insulinproduksjon kan opprettholdes, og utviklingen til enda mer alvorlig diabetes forsinkes.
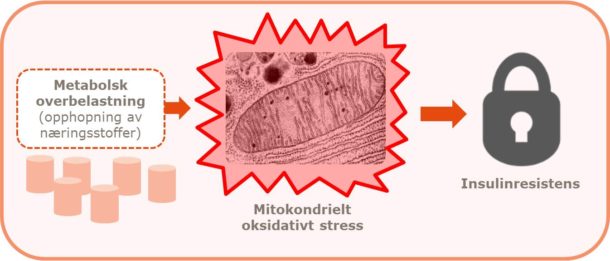
Figur 3. Kaloriforgiftning. Vedvarende kalorioverskudd medfører metabolsk overbelastning og oksidativt stress i kroppens celler. Deres beskyttelse er å indusere insulinresistens for å redusere næringstilførselen (9).
Insulinfølsomhet og perifert glukoseopptak kan forbedres både ved fysisk aktivitet og ved kalorireduksjon. Helt siden 1939 har vi visst at kalorrestriksjon forbedrer glukosehomeostasen hos personer med type 2-diabetes (17). Overvektige personer med type 2-diabetes kan sågar få normalisert sitt fastende blodsukker etter kun én uke med betydelig kalorirestriksjon (inntak av 600 kcal/dag) (18). I løpet av 8 uker ble også betacellefunksjon, hepatisk insulinsensitivitet, hepatisk og pankreatisk fettinnhold og HbA1c betydelig forbedret; rent biokjemisk en reversering av den type 2-diabetiske tilstanden. I den nylig publiserte DiRECT-studien gjennomførte man kalorirestriksjon i allmennpraksis (inntak av 825-850 kcal/dag) og oppnådde remisjon av type 2-diabetes hos nær halvparten av deltagerne (19). I subgruppen av dem med høyest vektreduksjon (≥15 kg) var remisjonsraten 86%.
I større randomiserte studier er det vist at progresjonen fra nedsatt glukosetoleranse til type 2-diabetes kan reduseres med opptil 60% med livsstilsendringer (20, 21). På den annen side så man ingen effekt av intensive livsstilsendringer på kardiovaskulær død i Look-AHEAD-studien (22). Her kan man argumentere for at man ikke klarte å oppnå vedvarende endring i livsstil ettersom initial vektreduksjon og forbedring av metabolske parametre var midlertidig. Dette antyder at den aller største utfordringen ikke er vektreduksjon i seg selv, men opprettholdelse av vektreduksjonen med en ny livsstil over tid. Hvis man gjennomfører livslang kalorirestriksjon hos rhesusaper (30% reduksjon vs ad libitum i kontrollgruppen) ser man en signifikant reduksjon i mortalitet (nesten 3 ganger høyere hasard-ratio for aldersrelatert dødlighet i kontrollgruppen) (23).
Bariatrisk kirurgi er et annet eksempel på at kalorirestriksjon normaliserer blodsukkeret raskt og over tid (24), og ser ut til å kunne ha en gunstig effekt på kardiovaskulær sykdom (25). Hvis man gjennomfører kalorirestriksjon på samme nivå som det man oppnår med bariatrisk kirurgi, oppnår man samme forbedring i insulinresistens og betacellefunksjon hos personer med type 2-diabetes (26). Disse dataene antyder at kaloriforgiftning har en vesentlig betydning for patogenesen til type 2-diabetes, og med tanke på at insulinresistens opptrer så tidlig i sykdomsforløpet, bør livsstilsendringer være sentrale både i forebyggelsen og behandlingen av sykdommen.
Interessekonflikter: Forfatteren er ansatt i Novo Nordisk
Referanser
1. Kahn SE et al. Pathophysiology and treatment of type 2-diabetes: perspectives on the past, present, and future. Lancet. 2013 S0140-6736(13)62154-6
2. DeFronzo RA. Lilly Lecture: The triumvirate: beta-cell, muscle, liver: a collusion responsible for NIDDM. Diabetes 1988; 37:667-687
3. Jallut D, Golay A, Munger R et al. Impaired glucose tolerance and diabetes in obesity: a 6-year follow-up study of glucose metabolism. Metabolism 1990; 39: 1068 – 75.
4. Brands M, Swat M, Lammers NM et al. Effects of a hypercaloric diet on β-cell responsivity in lean healthy men. Clin Endocrinol (Oxf) 2013; 78: 217 – 25.
5. Nolan CJ, Ruderman NB, Kahn SE et al. Insulin resistance as a physiological defense against metabolic stress: implications for the management of subsets of type 2 diabetes. Diabetes 2015; 64: 673 – 86.
6. Taegtmeyer H, Beauloye C, Harmancey R et al. Insulin resistance protects the heart from fuel overload in dysregulated metabolic states. Am J Physiol Heart Circ Physiol 2013; 305: H1693 – 7.
7. Schenk S, Saberi M, Olefsky JM. Insulin sensitivity: modulation by nutrients and inflammation. J Clin Invest 2008; 118: 2992 – 3002.
8. Unger RH. Lipid overload and overflow: metabolic trauma and the metabolic syndrome. Trends Endocrinol Metab 2003; 14: 398 – 403.
9. Hoehn KL, Salmon AB, Hohnen-Behrens C et al. Insulin resistance is a cellular antioxidant defense mechanism. Proc Natl Acad Sci U S A 2009; 106: 17787 – 92.
10. Steven S, Hollingsworth KG, Small PK et al. Weight loss decreases excess pancreatic triacylglycerol specifically in type 2 diabetes. Diabetes Care 2016; 39: 158 – 65.
11. Dirks ML, Wall BT, van de Valk B et al. One Week of Bed Rest Leads to Substantial Muscle Atrophy and Induces Whole-Body Insulin Resistance in the Absence of Skeletal Muscle Lipid Accumulation. Diabetes. 2016 65:2862-75.
12. Bays HE, Chapman RH, Grandy S. The relationship of body mass index to diabetes mellitus, hypertension and dyslipidaemia: comparison of data from two national surveys. Int J Clin Pract 2007; 61: 737 – 47.
13. Wang MY, Grayburn P, Chen S et al. Adipogenic capacity and the susceptibility to type 2 diabetes and metabolic syndrome. Proc Natl Acad Sci U S A2008; 105: 6139 – 44.
14. Lotta LA et al. Integrative genomic analysis implicates limited peripheral adipose storage capacity in the pathogenesis of human insulin resistance. Nat Genet. 2017 49:17-26
15. Yaghootkar H, Scott RA, White CC, et al. Genetic evidence for a normal-weight «metabolically obese» phenotype linking insulin resistance, hypertension, coronary artery disease, and type 2 diabetes. Diabetes. 2014 63:4369-77.
16. Methi T, Thorsby PM. Hvorfor får ikke alle type 2-diabetes? Tidsskr Nor Legeforen 2014; 134: 2284 – 6.
17. Newburgh LH og Conn JW. A new interpretation of hyperglycemia in obese middleaged persons. JAMA. 1939; 112:7-11.
18. Lim EL et al. Reversal of type 2-diabetes: normalisation of beta cell function in association with decreased pancreas and liver triacylglycerol. Diabetologia. 2011 54:2506-14.
19. Lean ME, Leslie WS, Barnes AC, et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT): an open-label, cluster-randomised trial. Lancet. 2017. pii: S0140-6736(17)33102-1.
20. Tuomilehto J et al. Prevention of type 2-diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med. 2001 344:1343-50.
21. The Diabetes Prevention Program Research Group. Reduction in the incidence of type 2-diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346: 393–403
22. Wing RR, Bolin P, Brancati FL et al. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013; 369: 145 – 54.
23. Colman RJ, Beasley TM, Kemnitz JW, et al. Caloric restriction reduces age-related and all-cause mortality in rhesus monkeys. Nat Commun. 2014 5:3557.
24. Mingrone G, Panunzi S, De Gaetano A et al. Bariatric-metabolic surgery versus conventional medical treatment in obese patients with type 2 diabetes: 5 year follow-up of an open-label, singlecentre, randomised controlled trial. Lancet 2015; 386: 964 – 73.
25. Eliasson B, Liakopoulos V, Franzén S et al. Cardiovascular disease and mortality in patients with type 2 diabetes after bariatric surgery in Sweden: a nationwide, matched, observational cohort study. Lancet Diabetes Endocrinol 2015; 3: 847 – 54.
26. Jackness C, Karmally W, Febres G et al. Very lowcalorie diet mimics the early beneficial effect of Roux-en-Y gastric bypass on insulin sensitivity and beta-cell Function in type 2 diabetic patients. Diabetes 2013; 62: 3027 – 32.