Medikamentell behandling og revaskularisering har sammen med bedret livsstil bedret prognosen etter hjerteinfarkt de siste tiårene. Artikkelen gjennomgår gjeldende retningslinjer for hjerteinfarktpasienter.
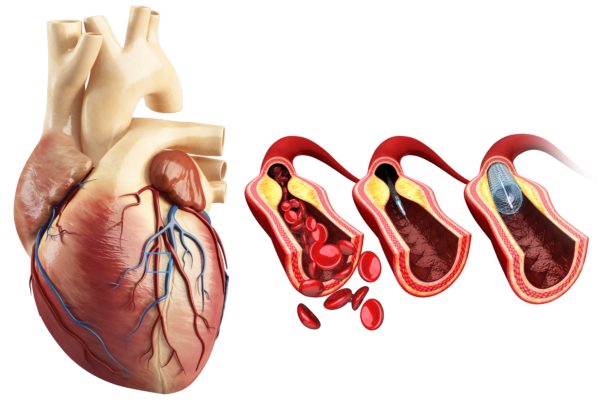
Vi har hatt en klar nedgang i dødsfall pga hjerte- og karsykdom i Norge de siste tiårene. Dette gjelder for både hjerteinfarkt og annen iskemisk hjertesykdom, og for hjerneslag. Ifølge Dødsårsaksregisteret synker fortsatt hjerte- og kardødeligheten. Bare siden år 2000 er denne halvert fra 515 til 245 per 100 000 nordmenn i 2016. Levealderen øker parallelt og er nå rekordhøye 84,2 år for kvinner og 80,6 år for menn. Den gunstige utviklingen skyldes trolig bedre behandling og et sunnere levesett med reduksjon av kjente risikofaktorer. Imidlertid får fortsatt over 13 000 personer hjerteinfarkt hvert år i Norge. Vi har effektiv akuttbehandling og veldokumenterte medikamenter til bruk. Vi vet en god del, men fortsatt ikke nok om optimalt levesett etter hjerteinfarkt. Fortsatt får mange av pasientene nye hjerteinfarkter, særlig det første året. En hovedutfordring er å få pasientene på riktig medikasjon og å få dem til å følge livsstilsrådene.
I følge Norsk hjerteinfarktregister var 24 % av hjerteinfarktene i 2016 ST-elevasjons myokardinfarkter (STEMI), mens 73 % var uten ST-elevasjon (NSTEMI). 3,5 % av infarktene var ikke nærmere klassifisert. Etter en gjennomgang av de siste retningslinjene fra European Society of Cardiology (ESC) for NSTEMI fra 2015 (1), de ferskere retningslinjene for STEMI (2), og for dobbel antitrombotisk behandling ved koronarsykdom fra 2017 (3), presenteres her en oversikt over oppdaterte anbefalinger for behandling og oppfølging etter akuttbehandlingen ved hjerteinfarkt.
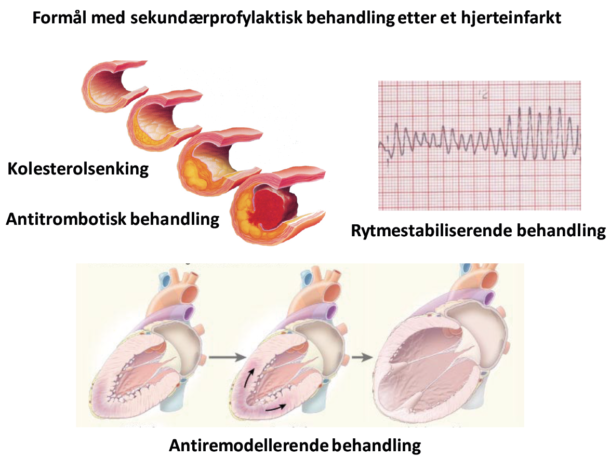
Tidlig revaskularisering og medikamentell behandling har redusert livstruende arytmier i akuttfasen etter et hjerteinfarkt til 3 %. De fleste arytmier oppstår innen 12 timer etter symptomdebut (4,5). Ved livstruende arytmier foreligger ofte kjent hjertesvikt og/eller trekarsykdom. Pasienter med NSTEMI med lav risiko for arytmier trenger rytmeovervåkning i 24 timer. Ved koronar revaskularisering kan eventuelt rytmeovervåkningen opphøre etter prosedyren. Pasienter med intermediær eller høy risiko for arytmier bør derimot rytmeovervåkes i minst 24 timer på overvåkningsavdeling eller hjerteavdeling/-post, avhengig av grad av revaskularisering og forløp/tilstand etter. Pasienter med NSTEMI som innlegges like etter symptomdebut med lett eller moderat troponinstigning, som har normal venstre ventrikkelfunksjon, og fått utført vellykket PCI av énkarsykdom, kan utskrives allerede dagen etter. Pasienter med flerkarsykdom uten komplett revaskularisering, komplisert forløp, arytmier, stor myokardskade, høy alder eller annen kompliserende hjertesykdom bør derimot ligge lengre. STEMI-pasienter kan ofte utskrives etter 48-72 timer ved vellykket revaskularisering, ukomplisert forløp og lav risiko (alder < 70 år, ejeksjonsfraksjon (EF) > 45 %, én- eller tokarsykdom, fravær av persisterende arytmier). Vi har på Diakonhjemmet Sykehus god erfaring med at pasienter utskrives 2-3 dager etter symptomdebut ved de fleste tilfeller av både NSTEMI og STEMI. Dette etter ekkokardiografi, god informasjon om videre medisinering, mobilisering og oppfølging samt samtale og vurdering av fysioterapeut før utskrivning.
Lengde på sykemelding avhenger av faktorer som størrelse på hjerteinfarktet, hjertefunksjon og type arbeid. Pasienter uten fysisk belastende arbeid kan ofte klare seg med maksimalt 2 ukers sykemelding, mens pasienter med vanlig kroppslig arbeid gjerne kan returnere til jobb i løpet av 3 uker. Og ved hardt kroppsarbeid innen 4-6 uker avhengig av myokardskade.
Retningslinjene til ESC vedrørende flyreiser angir at kun pasienter med fortsatt iskemiske plager eller betydelig redusert venstre ventrikkeldysfunksjon bør vente med å fly i 4-6 uker. Etter et ukomplisert hjerteinfarkt med fullstendig revaskularisering og EF > 40 %, er det neppe grunnlag for å fraråde flyreise etter utskrivning, dvs. fra dag 3. Har man derimot hatt et komplisert forløp etter STEMI med hjertesvikt, EF < 40 %, fortsatte iskemisymptomer eller arytmier, bør flyreise avventes til tilstanden er stabil.
Etter de nyeste førerkortforskriftene fra 1. oktober 2016 er mer overlatt til spesialistene og mindre skal meldes til Fylkesmannen. Helsekravet til førerkortgruppe 1 (mopeder, motorsykler, personbiler, beltekjøretøy og traktorer) er oppfylt først etter 4 uker, dersom det ikke foreligger angina pectoris i hvile eller emosjonell belastning, malign arytmi eller hjertesvikt i funksjonsklasse IV. For førerkortgruppe 2 (tyngre kjøretøy) og 3 (tyngre kjøretøy beregnet for personbefordring som buss og taxi samt utrykningskjøretøy og andre kjøretøy som krever kjøreseddel eller kompetansebevis) er helsekravet for førerkort oppfylt først etter 6 uker, men kun dersom det ikke er angina pectoris i hvile eller ved emosjonell belastning, eller malign arytmi, og arbeids-EKG er normalt ved 75 % belastning, EF > 35 % og funksjonsklasse I eller II. For førerkortgruppe 2 og 3 kreves også bruk av legemidler som reduserer kardiovaskulær risiko, og helseattest kan gis for inntil ett år før den kan gis med vanlig varighet.
Epikrisen etter sykehusoppholdet bør etter min mening inneholde anbefalinger til fastlege når det gjelder videre oppfølging inkludert medisinering med opptrappingsplan og dosemål samt behandlingslengde for de forskjellige medikamentene i tillegg til anbefalinger for reduksjon av koronare risikofaktorer.
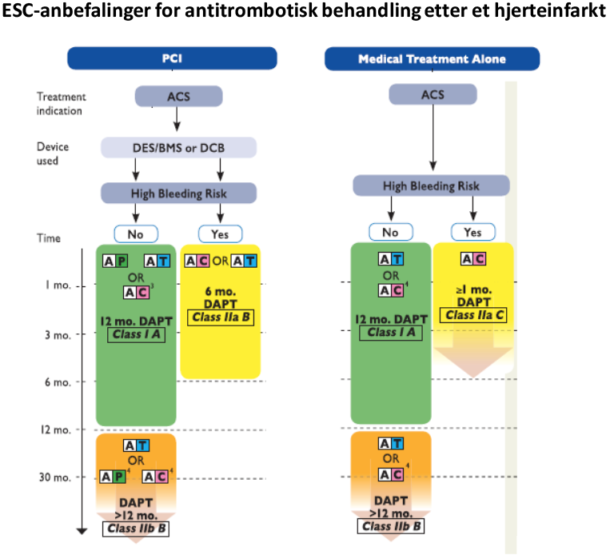
Fra 2017 Focused update on DAPT in CAD, ref 3 (trykkes med tillatelse)
a) Acetylsalisylsyre
Metaanalysen til Antithrombotic Trialists’ Collaboration publisert i BMJ 2002 viste at behandling med acetylsalisylsyre (ASA) i gjennomsnitt over 2 år etter tidligere hjerteinfarkt, reduserte hyppigheten av non-fatalt hjerteinfarkt og hjerneslag med hhv. 28 % og 36 %, mens hyppigheten av vaskulær død og total dødelighet var redusert med hhv. 15 % og 11 % (6). Det var ingen fordel med høyere dagsdoser enn 75-150 mg. Funnene ble bekreftet i CURRENT-OASIS 7-studien fra 2010 (7). Langtidsbehandling med ASA er imidlertid dårligere dokumentert (8).
b) P2Y12– reseptorhemmere
CURE-studien fra 2001 viste at dobbel blodplatehemmende behandling (DAPT) med ASA og klopidogrel i opptil 12 måneder etter NSTEMI, reduserte hyppigheten av kardiovaskulær død, ikke-fatalt hjerteinfarkt og hjerneslag med 20 %, sammenlignet med ASA alene, riktignok med 38 % flere større blødninger, men ikke livstruende (9). Likevel får opptil 10 % av pasientene med kombinasjonen ASA og klopidogrel nye iskemiske hendelser det første året (10). Delvis oppnår man ikke optimal blodplatehemming av klopidogrel pga. stor variabilitet i den blodplatehemmende responsen (11, 12, 13). P2Y12-reseptorhemmerne prasugrel og tikagrelor har vist bedre effekt enn klopidogrel på iskemiske hendelser etter hjerteinfarkt, med samtidig økt blødningshyppighet (14, 15). Prasugrel skal bare brukes hos pasienter behandlet med PCI og er kontraindisert hos pasienter etter hjerneslag eller TIA. Hvis pasienter ≥ 75 år eller vekt < 60 kg skal behandles med prasugrel, bør dosen halveres til 5 mg daglig. Pasienter som behandles med tikagrelor har 10 % økt hyppighet av tungpustenhet uten bronkospasme. Årsaken til dette er ikke kjent.
Valget mellom prasugrel og tikagrelor ved STEMI og NSTEMI er likestilt i retningslinjene fra ESC. Norsk hjerteinfarktregister viste at 94,1% av STEMI-pasientene ble revaskularisert i 2016, og de fleste med PCI. Kun 76% av NSTEMI-pasientene ble utredet invasivt, og langt fra alle blir behandlet med PCI. De fleste sykehus i Helse Sør-Øst har prasugrel som førstevalg ved STEMI, mens tikagrelor er førstevalg ved NSTEMI (18).
Det er i de siste retningslinjene for dobbel antitrombotisk behandling anbefalt å bruke protonpumpehemmer hos pasienter på DAPT.
Omlag 6–8% av pasientene som behandles med PCI har indikasjon for antikoagulasjon pga. atrieflimmer, mekanisk hjerteklaff eller venøs tromboembolisme siden blodplatehemmere er lite effektive ved disse tilstandene. Ulempen er selvfølgelig at blødningsrisikoen øker betydelig ved trippel antitrombotisk behandling (19). Optimal lengde av trippelbehandling er usikker. ISAR-TRIPLE-studien sammelignet trippelbehandling (warfarin+klopidogrel+ASA) i 6 uker mot 6 måneder uten å finne forskjell i død, hjerteinfarkt, stenttrombose, hjerneinfarkt eller alvorlig blødning ved kort eller lang trippelbehandling. I nyere studier er warfarin sammelignet med non-vitamin K-antagonist oral antikoagulantia (NOAK) hos pasienter med enten dobbel- eller trippelbehandling etter PCI. PIONEER AF-PCI-studien viste at rivaroksaban (15 mg) + en P2Y12-hemmer eller trippelbehandling med lav dose rivaroksaban (2,5 mg ×2) + ASA + en P2Y12-hemmer førte til færre blødninger enn standard trippel behandling med warfarin (22). De tre behandlingsgruppene var like effektive for iskemiske hendelser. I RE-DUAL PCI-studien ble dabigatran i vanlig (150 mg ×2) eller lav dose (110 mg ×2) + en P2Y12-hemmer sammenlignet med standard trippel antitrombotisk behandling med warfarin, ASA og P2Y12-hemmer (23). Også her hadde dobbel antitrombotisk behandling med dabigatran færre blødningshendelser enn trippelbehandling med warfarin, uten at man så økning i tromboemboliske hendelser. Nylig viste AUGUSTUS-studien at trippelbehandling med apiksaban i normal dose ga færre blødningstilfeller enn trippelbehandling med warfarin uten økning i iskemiske hendelser samt at dobbelbehandling med oral antikoagulasjon og P2Y12-hemmer førte til færre blødninger enn trippelbehandling med ASA, igjen uten signifikant økning av blødninger. Det er imidlertid et problem at studiene der dobbel antitrombotisk behandling er sammenlignet med trippel har hatt lav statistisk styrke når det gjaldt å se på effekt på iskemiske hendelser. ESC anbefaler at dobbel antitrombotisk behandling med klopidogrel og oral antikoagulasjon, foreløpig bør vurderes hos pasienter behandlet med PCI når blødningsrisiko overgår den iskemiske risikoen. Pga. lavere blødningsrisiko bør man etter mitt syn med unntak for pasienter med mekanisk hjerteventil eller mitralstenose bruke en NOAK fremfor warfarin ved dobbel- og trippel antitrombotisk behandling, og det anbefales å bruke lavest dokumenterte dose som er 110 mg x2 for dabigatran, 15 mg x1 for rivaroksaban, men 5 mg x2 for apiksaban og 60 mg x1 for edoksaban.
ASA anbefales livslangt etter et hjerteinfarkt. Unntaket er pasienter som også behandles med antikoagulasjon, der det i utgangspunktet anbefales antikoagulasjon i monoterapi 1 år etter infarkt. Retningslinjene legger imidlertid opp til individuell vurdering om det likevel bør fortsettes med dobbel antitrombotisk behandling pga kompleksitet av lesjonen, tekniske forhold ved PCI, mengde ubehandlet karsykdom og tromboserisiko. DAPT anbefales i 12 måneder, såfremt det ikke er stor blødningsrisiko. De siste ESC retningslinjene åpner også for fortsatt behandling med lavdose tikagrelor (60 mg ×2) i inntil 3 år for høyrisikopasienter (pasienter ≥ 50 år med minst én av følgende: alder ≥ 65 år, medikamentbehandlet diabetes mellitus, tidligere hjerteinfarkt, flerkarsykdom eller kronisk nyresvikt) som har tolerert DAPT-behandling i 12 måneder uten blødningskomplikasjoner. Denne anbefalingen bygger på resultatene fra PEGASUS-TIMI 54-studien (24) der pasienter med tidligere hjerteinfarkt behandlet med tikagrelor 60 mg ×2 hadde reduksjon i primært endepunkt (kardiovaskulær død, hjerteinfarkt eller hjerneslag) på 16 % sammenlignet med placebo, mot en økning i alvorlige blødningstilfeller på 2,3 %.
COMPASS-studien undersøkte om rivaroksaban alene eller i kombinasjon med ASA er mer effektivt enn ASA alene som sekundærprevansjon hos pasienter med koronar eller perifer karsykdom randomisert til tre grupper: rivararoksaban 5 mg × 2 eller 2,5 mg × 2 + ASA eller ASA alene. Behandlingsregimet som kom best ut, var ASA + rivaroksaban 2,5 mg × 2 med 20-25 % relativ risikoreduksjon for alvorlige kardiovaskulære hendelser, men på bekostning av en økning i blødningstilfeller (25).
Utfordringer fremover blir å velge ut pasienter med særlig høy risiko for iskemiske hendelser og lav risiko for blødninger, som kan være aktuelle for enten forlenget behandling med lavdose tikagrelor eller rivaroksaban i tillegg til ASA. Andre med høy blødningsrisiko bør vurderes for å forkorte behandlingsperioden med to blodplatehemmere i forhold til de anbefalte 12 månedene. Skåringsverktøyene PRECISE-DAPT-skår kan brukes til å selektere pasienter med økt blødningsrisiko som kan profitere på mindre enn 12 måneders dobbel blodplatehemmende behandling etter hjerteinfarkt, og DAPT-skår for å selektere pasienter som kan profitere på behandling utover 12 måneder.
Høyintensitets-statinbehandling (atorvastatin 40-80 mg eller rosuvastatin 20-40 mg daglig) er anbefalt så tidlig som mulig etter et hjerteinfarkt. Målet er å redusere LDL-kolesterol < 1,8 mmol/l. For pasienter med et relativt lavt LDL-kolestrolnivå, 1,8-3,5 mmol/l, er anbefalingen å senke LDL-kolesterol med minst 50 %. Statiner anbefales nå for de fleste uavhengig av LDL-kolesterolnivå. Det er godt dokumentert at enhver reduksjon i LDL-kolesterol er gunstig (26). I de nyeste europeiske retningslinjene er det ikke satt en aldersgrense for behandling. Imidlertid bør man vurdere mindre intens statinbehandling hos pasienter med økt risiko for bivirkninger som eldre pasienter, pasienter med nyresvikt, pasienter med leverpatologi og pasienter med tidligere sannsynlig statinbivirkninger.
Hvis statinbehandling ikke gir LDL-kolesterol <1,8 mmol/l, anbefales å vurdere ytterligere lipidsenking. IMPROVE-IT-studien viste at ezetimib i tillegg til simvastatin ga 6 % relativ risikoreduksjon i kardiovaskulær død, hjerteinfarkt, hospitalisering pga. ustabil angina pectoris, koronar revaskularisering og hjerneslag (27). PCSK9-hemmerne er potente lipidsenkende medikamenter med opptil 60 % reduksjon av LDL-kolesterol, også som tillegg til statiner. I FOURIER-studien medførte behandling med PCSK9-hemmeren evolokumab 15 % reduksjon i død, hjerteinfarkt, hospitalisering pga. ustabil angina pectoris, koronar revaskularisering og hjerneslag (26). Det er imidlertid ikke vist effekt på mortalitet for verken ezetimib eller evolokumab. Den andre PCSK9-hemmeren, alirocumab, reduserte kardiovaskulære hendelser med 15 % og totaldødelighet med 15 % som tillegg til optimal statinbehandling (ODYSSES-studien). Oppfølgingstid var i gjennomsnitt 2,8 år. De nye PCSK9-hemmerne er dyre, og muligheten for individuell refusjon for disse som sekundærprofylakse er foreløpig begrenset til LDL-kolesterol ≥ 4 mmol/l under pågående behandling med maksimalt tolererbare doser av statin og/eller ezetemib.
Betablokker har lenge vært en av hjørnestenene i behandling etter hjerteinfarkt (28). Nytten av behandling med betablokker etter moderne hjerteinfarktbehandling med reperfusjon og stentimplantasjon samt aggressiv antitrombotisk behandling og statinbehandling er imidlertid ikke undersøkt. Nyere observasjonsstudier har vist motstridende resultater av betablokkerbehandling etter hjerteinfarkt. Den norske placebokontrollerte multisenter-studien BETAMI undersøker nå hvorvidt metoprolol er gunstig som sekundærbehandling etter hjerteinfarkt.
Retningslinjene til ESC anbefaler at hjerteinfarktpasienter med redusert systolisk venstre ventrikkelfunksjon (EF ≤ 40 %) bør få betablokker. Videre anbefales at alle STEMI-pasienter bør vurderes for behandling med betablokker uavhengig av EF. I de amerikanske retningslinjene anbefales 3 års behandling for alle med akutt koronarsyndrom og normal venstre ventrikkelfunksjon. For pasienter med lett nedsatt venstre ventrikkelfunksjon (EF 40-49%) taler en metaanalyse fra 2018 for at betablokkerbehandling reduserer kardiovaskulær og total dødelighet tilsvarende som for pasienter med EF ≤ 40 % (30).
ACE-hemmer eller angiotensin II-reseptorblokker anbefales hos alle pasienter med nedsatt systolisk venstre ventrikkelfunksjon med EF ≤ 40 %, hypertensjon eller diabetes. Data indikerer også at pasienter med hjertesviktsymptomer og EF 40-50 % har samme nytte av behandling. I CHARM-studien hadde behandling med candesartan god effekt hos pasienter med EF 40-49 % tilsvarende som ved EF < 40 %. Etter mitt syn bør man vurdere å behandle også hjerteinfarktpasienter med EF 40-50 % med både betablokker og ACE-hemmer/angiotensin II-reseptorblokker.
Behandling med en mineralkortikoidreseptorantagonist anbefales i ESC sine STEMI-retningslinjer for pasienter med EF ≤ 40 % med hjertesviktsymptomer eller diabetes som allerede behandles med ACE-hemmer/angiotensin II-reseptorblokker og betablokker (uten nyresvikt/hyperkalemi).
I GISSI Prevenzione-studien fra 1999 fikk hjerteinfarktpasienter behandlet med omega-3-fettsyrer en 10 % reduksjon i risiko for alvorlige kardiovaskulære hendelser (32). Det har vært vanskelig å reprodusere den samme gunstige effekten i nyere studier, muligens pga. bedre medikamentell behandling, ikke minst med statiner i risikopopulasjoner. En helt fersk metaanalyse med totalt 77 917 personer fant ingen signifikant assosiasjon mellom tilskudd av omega-3-fettsyrer og redusert risiko for koronar hjertesykdom og vaskulære hendelser (33). Imidlertid viste nylig REDUCE-IT-studien at høy dose med omega-3-fettsyren EPA hos pasienter med lett forhøyede triglyceridnivåer reduserte risikoen for iskemiske hendelser inkludert 20 % relativ risikoreduksjon for kardiovaskulær død.
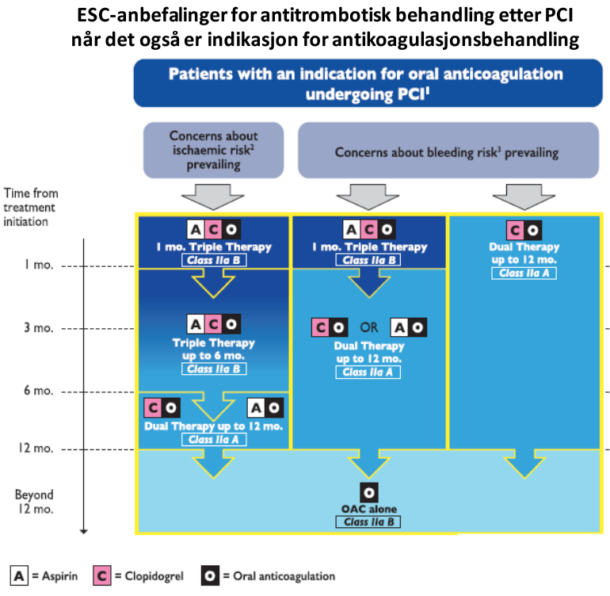
Fra 2017 Focused update on DAPT in CAD, ref 3 (trykkes med tillatelse)
Røykeslutt er svært effektivt for å redusere sykelighet og dødelighet etter akutt koronarsyndrom. Det er mulig det mest effektive av alle sekundærpreventive tiltak (34, 35). Røykeslutt bør tilstrebes allerede fra sykehusoppholdet, bl.a. vha. røykeavvenningskurs og farmakologisk behandling med nikotinerstatningsprodukter, bupropion eller vareniklin (36-38).
ESC anbefaler å begrense alkoholinntaket til maks 20 g alkohol daglig for menn og 10 gram for kvinner (omtrent to alkoholenheter for menn og én for kvinner). Befolkningsstudier kan tale for at et inntak på to alkoholenheter for menn og én for kvinner kan være gunstig (39,40). Det er likevel vanskelig å trekke sikre konklusjoner (41).
ESC anbefaler et kosthold tilsvarende middelhavsdietten der maksimalt 10 % av energiinntaket kommer fra mettet fett og minst mulig transfett, begrenset saltinntak og inntak av mye fiber, frukt, grønnsaker og nøtter. To randomiserte, kontrollerte studier har vist reduksjon i hjerte- og karsykdom ved dette kosthold (42, 43). I PREDIMED-studien ga middelhavskost beriket med kaldpresset olivenolje eller nøtter redusert insidens av hjerte- og karsykdom hos høyrisikopersoner med ca. 30 %, sammenlignet med et mer fettredusert kosthold (43,44). I Lyon Heart-studien fant man 37 % lavere risiko for kardiovaskulære hendelser ved sekundærpreventiv kostomlegging til middelhavskost med tillegg av rapsoljebasert margarin (45).
Den såkalte nordiske dietten er foreslått som Nordens «middelshavsdiett». Denne dietten er basert på tradisjonell mat fra de nordiske landene med mindre sukker og fett og mer fiber (grovt brød, grønnsaker, m.m), fisk og sjømat enn en gjennomsnittlig vestlig diett. Selv om dietten har vist gunstige effekter på vekt, blodtrykk, lipidprofil og inflammasjon, mangler den dokumentasjon på harde endepunkter (46,47).
Fedme (kroppsmasseindeks (KMI) ≥ 30 kg/m2) bør unngås, fordi dette er assosiert med økt dødelighet. Spesielt abdominal fedme ser ut til å være ugunstig. Det anbefales også å unngå overvekt (KMI 25-30 kg/m2), selv om dataene ikke er like overbevisende. Overvekt er ofte kombinert med lite fysisk aktivitet, og dette må sees i sammenheng.
Fysisk aktivitet er viktig etter et hjerteinfarkt. Trening bedrer endotelfunksjon, reduserer progresjon av koronare lesjoner, reduserer trombogen risiko og bedrer dannelse av kollateraler i koronarforsyningen. Trening er en sentralt i hjerterehabilitering etter innleggelse for et hjerteinfarkt. ESC anbefaler at alle hjerteinfarktpasienter deltar i treningsbasert hjerterehabilitering og at det bør tilstrebes at hjerterehabiliteringen i tillegg inneholder arbeid med å redusere byrden avrisikofaktorer, stressmestring og psykososial støtte. «Hjerteskole» med undervisning har en viktig rolle i å informere, motivere og trygge pasienter som har hatt et hjerteinfarkt. I en metaanalyse fra 2016 var fysisk aktivitet, som del av hjerterehabiliteringsprogram for pasienter med koronarsykdom, assosiert med 22 % lavere kardial mortalitet (48).
Hjerterehabilitering med trening kan deles inn i flere faser. Fase 1 omfatter typisk de 2 første ukene etter et hjerteinfarkt og starter gjerne på sykehuset før utskrivning. Inkludert er test av fysisk yteevne f.eks. ved trappegang og deretter tilpasset daglig lett fysisk aktivitet. Etter 2 uker kan man starte med organisert og veiledet opptrening (fase 2) med høyere intensitet. Fase 2a bør tilbys de fleste og varer typisk frem til 4-8 uker etter hjerteinfarktet. Denne treningen foregår som oftest i grupper på sykehus, ev. på institusjon, ofte 2 ganger i uken med lav til moderat intensitet. Mange steder er treningen kombinert med hjerteskole på et lærings- og mestringssenter eller tilsvarende. For noen er det aktuelt med videre og mer intensivert trening (fase 2b), ofte opp til 1/2 år. I denne fasen foregår som oftest treningen utenfor sykehus på et treningssenter med veiledning av fysioterapeut. Den siste fasen, fase 3, er trening som ideelt sett skal vare resten av livet. Nasjonal faglig retningslinje for forebygging av hjerte- og karsykdom fra Helsedirektoratet anbefaler at voksne og eldre bør være fysisk aktive i minst 150 minutter med moderat intensitet per uke eller minst 75 minutter med høy intensitet per uke. Anbefalingen kan også oppfylles med en kombinasjon av moderat og høy intensitet.
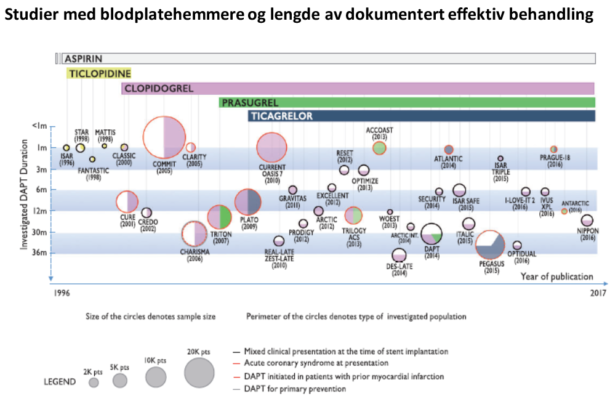
Fra 2017 Focused update on DAPT in CAD, ref 3 (trykkes med tillatelse)
Det er god evidens for nytten av både medikamentell behandling og ikke-farmakologiske tiltak etter hjerteinfarkt. Det er imidlertid stadig en stor utfordring å få pasientene til å følge våre råd om å ta medisiner som forskrevet og endre livsstil med røykeslutt, kostomlegging, økt fysisk aktivitet og vektnedgang. For å oppnå dette må vi nok ta et større ansvar for oppfølgingen av hjerteinfarktpasientene en det som tilbys i dag.
Manuset er en noe forkortet og revidert versjon etter innlegg i Hjerteforum nr 2, 2018.
Referanser
1. Roffi M, Patrono C, Collet et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J 2016; 37: 267-315.
2. Ibanez B, James S, Agewall S et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J 2018; 39: 119-177.
3. Valgimigli M, Bueno H, Byrne RA et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2018; 39: 213-260.
4. Rahimi K, Watzlawek S, Thiele H et al. Incidence, time course, and predictors of early malignant ventricular arrhythmias after nonST-segment elevation myocardial infarction in patients with early invasive treatment. Eur Heart J 2006; 27: 1706–1711.
5. Piccini JP, White JA, Mehta RH et al. Sustained ventricular tachycardia and ventricular fibrillation complicating non-ST-segment-elevation acute coronary syndromes. Circulation 2012; 126: 41–49.
6. Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71–86.
7. Mehta SR, Bassand JP, Chrolavicius S et al. Dose comparisons of clopidogrel and aspirin in acute coronary syndromes. N Engl J Med 2010; 363: 930–942.
8. Cleland JG. Long-term aspirin for coronary artery disease: are we being deceived by a biased presentation of the evidence? Future Cardiol 2010; 6: 141-6.
9. Yusuf S, Zhao F, Mehta SR et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001; 345: 494–502.
10. Parodi G, Marcucci R, Valenti R et al. High residual platelet reactivity after clopido- grel loading and long-term cardiovascular events among patients with acute coronary syndromes undergoing PCI. JAMA 2011; 306: 1215–1223.
11. Matetzky S, Shenkman B, Guetta V et al. Clopidogrel resistance is associated with increased risk of recurrent atherothrombotic events in patients with acute myocardial infarction. Circulation 2004; 109: 3171–3175.
12. Simon T, Verstuyft C, Mary-Krause M et al. Genetic determinants of response to clopido- grel and cardiovascular events. N Engl J Med 2009; 360: 363–375.
13. Collet JP, Hulot JS, Pena A et al. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study. Lancet 2009; 373: 309–317.
14. Wiviott SD, Braunwald E, McCabe CH et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 2001–2015.
15. Wallentin L, Becker RC, Budaj A et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045–1057.
18. Eritsland J, Bendz B. Blodplatehemmende behandling ved akutt koronarsyndrom. Nye retningslinjer ved Oslo universitetssykehus (OUS). Hjerteforum 2012; 25: 35-38.
19. Hansen ML, Sorensen R, Clausen MT et al. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation. Arch Intern Med 2010; 170: 1433–1441.
22. Gibson CM, Mehran R, Bode C et al. Prevention of bleeding in patients with atrial fibrillation undergoing PCI. N Engl J Med 2016; 375: 2423-2434.
23. Cannon CP, Bhatt DL, Oldgren J et al. Dual antithrombotic therapy with dabigatran after PCI in atrial fibrillation. N Engl J Med 2017; 377: 1513-1524.
24. Bonaca MP, Bhatt DL, Cohen M et al. Longterm use of ticagrelor in patients with prior myocardial infarction. N Engl J Med 2015; 372: 1791–1800.
25. Eikelboom JW, Connolly SJ, Bosch J et al. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med 2017; 377: 1319-1330.
26. Sabatine MS, Giugliano RP, Keech AC et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376: 1713-1722.
27. Cannon CP, Blazing MA, Giugliano RP et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372: 2387-97.
28. Freemantle N, Cleland J, Young P et al. Beta blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999; 318: 1730–1737.
30. Cleland JGF, Bunting KV, Flather MD et al. Beta-blockers for heart failure with reduced, mid-range, and preserved ejection fraction: an individual patient-level analysis of double-blind randomized trials. Eur Heart J 2018; 39: 26-35.
32. GISSI-Prevenzione Investigators. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Lancet 1999; 354: 447-55.
33. Aung T, Halsey J, Kromhout D et al. Associ- ations of omega-3 fatty acid supplement use with cardiovascular disease risks: meta-analysis of 10 trials involving 77 917 individuals. JAMA Cardiol 2018; 3: 225-34.
34. Chow CK, Jolly S, Rao-Melacini P. Association of diet, exercise, and smoking modification with risk of early cardiovascular events after acute coronary syndromes. Circulation 2010; 121: 750-8.
35. Critchley JA, Capewell S. Mortality risk reduction associated with smoking cessation in patients with coronary heart disease: a systematic review. JAMA 2003; 290: 86-97.
36. Løchen M-L. Hjelp til røykeslutt for hjertepa- sienter. Hjerteforum 2011; 24: 33-40.
37. Rallidis LS, Pavlakis G. The fundamental importance of smoking cessation in those with premature ST-segment elevation acute myocardial infarction. Curr Opin Cardiol 2016; 31: 531–536.
38. Stead LF, Koilpillai P, Fanshawe TR et al. Combined pharmacotherapy and behavioural interventions for smoking cessation. Cochrane Database Syst Rev 2016; 3: CD008286.
39. Gaziano JM, Hennekens CH, Godfried SL et al. Type of alcoholic beverage and risk of myocardial infarction. Am J Cardiol 1999; 83: 52-7.
40. Leong DP, Smyth A, Teo KK et al. Patterns of alcohol consumption and myocardial infarction risk: observations from 52 countries in the INTERHEART case-control study. Circulation 2014; 130: 390-8.
41. Holmes MV, Dale CE, Zuccolo L et al. Association between alcohol and cardiovascular disease: Mendelian randomisation analysis based on individual participant data. BMJ 2014; 349: g4164.
42. de Lorgeril M, Renaud S, Mamelle N et al. Mediterranean alpha-linolenic acid-rich diet in secondary prevention of coronary heart disease. Lancet 1994; 343: 1454-9.
43. Estruch R, Ros E, Salas-Salvadó J et al. Primary prevention of cardiovascular disease with a Mediterranean diet. N Engl J Med 2013; 368: 1279-90.
44. Appel LJ, Van Horn L. Did the PREDIMED trial test a Mediterranean diet? N Engl J Med 2013; 368: 1353-4.
45. De Lorgeril M, Salen P, Martin JL et al. Effect of a mediterranean type of diet on the rate of cardiovascular complications in patients with coronary artery disease. Insights into the cardioprotective effect of certain nutriments. J Am Coll Cardiol 1996; 28: 1103-8.
46. Poulsen SK, Due A, Jordy AB et al. Health effect of the New Nordic Diet in adults with increased waist circumference: a 6-mo randomized controlled trial. Am J Clin Nutr 2014; 99: 35-45.
47. Uusitupa M, Hermansen K, Savolainen MJ et al. Effects of an isocaloric healthy Nordic diet on insulin sensitivity, lipid profile and inflammation markers in metabolic syndrome – a randomized study (SYSDIET). J Intern Med 2013; 274: 52-66.
48. Anderson L, Oldridge N, Thompson DR et al. Exercise-based cardiac rehabilitation for coronary heart disease: Cochrane Systematic Review and Meta-Analysis. J Am Coll Cardiol 2016; 67: 1-12.