Nefrosklerose er en sjukdom med nedsatt nyrefunksjon på grunn av langvarig høgt blodtrykk og/eller aterosklerotisk sjukdom i nyrene. Nefrosklerose er den antatt vanligste årsaken til endestadium nyresvikt i Norge, og etter diabetesnefropati er det den antatt vanligste årsaken til endestadium nyresvikt i industrialiserte land. Sjølv om tilstanden er godt kjent, er det paradoksalt nok debatt rundt både definisjonen, utbredelsen, årsakene og de grunnleggende sjukdomsmekanismene bak sjukdommen.
Nefrosklerose er synonymt med arterionefrosklerose, og er også kjent som hypertensiv nefropati i den internasjonale litteraturen. Uttrykket «nefrosklerose» er avledet fra gresk “nephros”, nyre, og “sklerosis”, hardhet. Betegnelsen ble første gang brukt av to tyske leger, patologen Theodor Fahr og nefrologen Franz Volhard, i publikasjonen “Die Brightsche Nierenkrankenheit” fra 1914 [1]. Andre navn på tilstanden er hypertensiv nefrosklerose og nefrangiosklerose.
Typiske histopatologiske funn er arteriell media-fortjukkelse og hyalin arteriolosklerose i afferente arterioler, som leder til forsnevring av blodkarets lumen. Videre kan man se arteriell media-hypertrofi, intima-sklerose og duplikasjon av elastiske laminae, jf. Figur 1. Varierende grader av fokale, glomerulære ischemiske forandringer med fortjukkelse og rynking av basalmembraner, mesangial matrix-økning, kapillær kollaps og glomerulosklerose sammen med tubulær atrofi og interstitiell fibrose sees også [2, 3, 4]. Disse forandringene er typiske for arterionefrosklerose, men er ikke unike for tilstanden. De kan sees også ved andre tilstander, som for eksempel aldring, slik nyrebiopsier av levende nyre-givere og obduksjonsmaterialer har vist [5, 6].
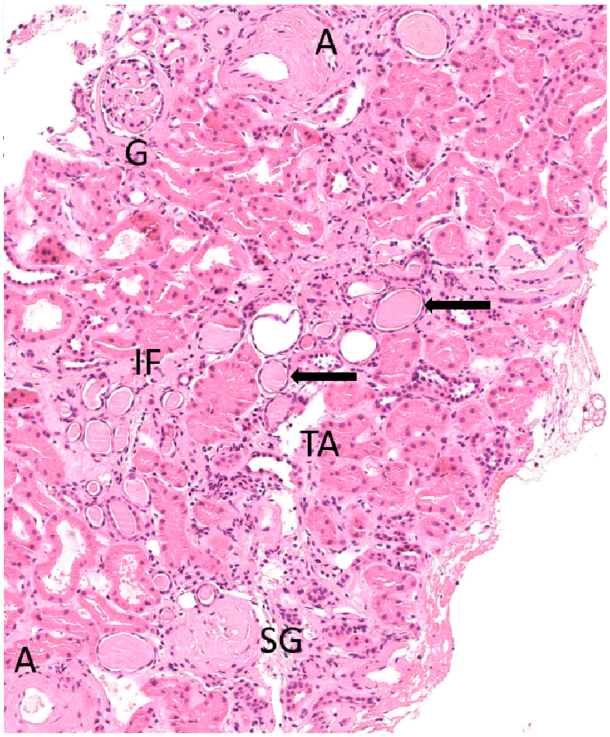
Figur 1. Lysmikroskopisk bilde av nefrosklerose. A: Arterie med hyalinose. G: Glomerulus med tidlige tegn til perikapsulær fibrose. SG: Sklerotisk glomerulus. IF: Interstitiell fibrose. TA: Tubulær atrofi med peritubulær fibrose. Piler: Tubuli med proteinøst innhold. Gjengitt med tillatelse fra patolog dr Tina Syvertsen Overrein, overlege i patologi, St Olavs Hospital.
Lysmikroskopisk bilde av nefrosklerose. A: Arterie med hyalinose. G: Glomerulus med tidlige tegn til perikapsulær fibrose. SG: Sklerotisk glomerulus. IF: Interstitiell fibrose. TA: Tubulær atrofi med peritubulær fibrose. Piler: Tubuli med proteinøst innhold. Gjengitt med tillatelse fra patolog dr Tina Syvertsen Overrein, overlege i patologi, St Olavs Hospital.
Arterionefrosklerose eller hypertensiv nefropati er tilskrevet som årsak til rundt 30 % av endestadium nyresvikt (ESRD) i Norge, jf. Figur 2. Det gjør det til den hyppigste årsaken til ESRD i Norge [7]. Det er også den nest hyppigste årsaken til ESRD i USA, og blant de hyppigste globalt [8].
Årsaker til nyresvikt i Norge 2000-2008, basert på tall fra Norsk nyreregister. RRT: renal replacement therapy (dialyse eller nyretransplantasjon). Gjengitt med tillatelse fra Torbjørn Leivestad, dr.med., tidligere overlege og seksjonsoverlege ved Immunologisk Institutt, Rikshospitalet.
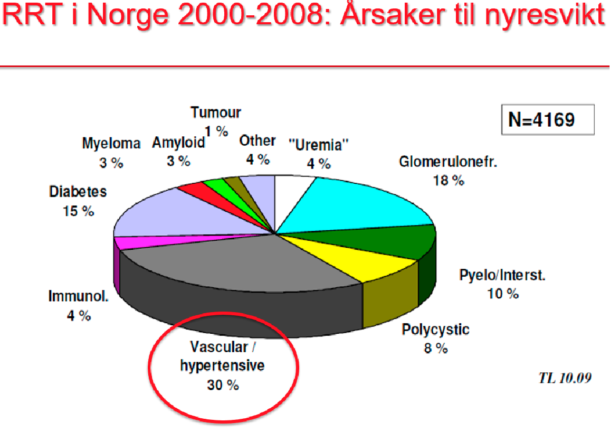
Figur 2. Årsaker til nyresvikt i Norge 2000-2008, basert på tall fra nasjonalt nyreregister. RRT: renal replacement therapy (dialyse eller nyretransplantasjon). Gjengitt med tillatelse fra Norsk Nyreregister ved Anna Varberg Reisæter.
Klinisk har arterionefrosklerose vært antatt årsak til kronisk nyresjukdom hos individer med nedsatt nyrefunksjon og langvarig høgt blodtrykk, kun sparsomme urinfunn (lite blod og lav proteinuri), og som ikke har tegn til andre sjukdommer som gir nyreskade (for eksempel sukkersyke, cystenyrer eller kronisk nyrebetennelse/glomerulonefritt). Tegn til endeorgan-skade av hypertensjonen, i form av venstre ventrikkelhypertrofi eller hypertensiv retinopati, kan styrke mistanken om denne diagnosen. Hos disse pasientene har man tidligere ofte antatt diagnosen hypertensiv nefropati uten å ta nyrebiopsi for bekreftelse [9, 10].
Det har vært debatt rundt den sanne forekomsten av nefrosklerose. Definitiv diagnose gjøres med nyrebiopsi. Da flesteparten av de innmeldte diagnosene til tradisjonelle nyreregister er gjort uten nyrebiopsi, har mange antatt at den reelle forekomsten av nefrosklerose er noe lavere enn det register-tallene tilsier. Praksisen med å anta arterionefrosklerose-diagnosen, uten støtte i biopsi, har vært kritisert siden 1990-tallet, da en studie av 43 pasienter med behov for nyre-transplantasjon på bakgrunn av antatt arterionefrosklerose viste at bare en håndfull var nyrebiopsert, og <10 % hadde dokumentert hypertensjon før nyresvikten debuterte [11].
Presisjonen til de tradisjonelle kliniske kriteriene i å predikere biopsi-verifisert hypertensiv nefrosklerose har vist seg variabel i flere studier, med positive prediktive verdier fra 50 % til 85 %, på tvers av forskjellige land og etniske bakgrunner [12, 13, 14, 15]. Flere forslag om justerte kliniske kriterier for økt presisjon i diagnostiseringa har vært foreslått, men det finnes per i dag ingen universelt aksepterte kriterier for diagnosen. Pasienter med arterionefrosklerose-suggestiv klinikk har tradisjonelt ikke blitt biopsert, og det er også et positivt seleksjonsbias for nyrebiopsi hos pasienter med proteinuri og/eller hematuri. Dette kan ha bidratt til systematisk under-biopsering av pasienter med arterionefrosklerose-liknende klinikk, og potensielt over-estimering av forekomsten i registerdata. Den optimale studien ville vært å systematisk biopsere og prospektivt følge alle insidente pasienter med en klinisk fenotype som ved arterionefrosklerose, men dette lar seg ikke gjennomføre verken praktisk eller medisinsk-etisk. Den sanne insidensen av arterionefrosklerose i befolkninga er derfor ikke sikker.
Flere samtidige patofysiologiske prosesser ser ut til å bidra i genesen av arterionefrosklerose. Kronisk renal ischemi på grunn av gradvis tilsnevring av nyrenes arterioler og tap av autoregulering av renal blodfløde, samt kronisk hyperfiltrasjon i de gjenværende nefronene og inflammasjon med fibrose, bidrar til at arterionefrosklerose har en kombinert ischemisk, metabolsk og inflammatorisk genese [16, 17]. De siste årene har man også gjort viktige framskritt innen forståelsen av den genetiske basisen for arterionefrosklerose. To varianter av APOL-genet (G1 og G2) har de siste åra blitt funnet å assosiere sterkt med både hypertensjon-assosiert kronisk nyresvikt, endestadium nyresvikt, og enkelte nyresjukdommer som fokal segmental glomerulosklerose (FSGS) og HIV-assosiert nefropati [18]. De to variantene er spesielt hyppig forekommende i populasjoner av afrikansk herkomst, og ser ut til å ha båret med seg en evolusjonær fordel mot Trypanosoma brucei, mikroben som gir sovesyke. Pasienter av alle etniske bakgrunner utvikler imidlertid arterionefrosklerose, og ikke alle av afrikansk herkomst har de to aktuelle variantene, så disse to gen-variantene forklarer nok ikke hele bildet, men har bidratt til ny forståelse.
Vår forskning, med kombinerte gen- og urin-analyser, viste at individer med hypertensiv nefropati har endringer innen flere områder av metabolismen, med spesielt redusert utskillelse i urin av flere typer aminosyrer sammenliknet med friske. Disse forskjellene peker mot forstyrrelser av blodtrykksregulering, åreforkalkning, arrdannelse/fibrose og oksidativt stress, som er kjente mekanismer i dannelsen av hypertensiv nefropati og nyresjukdom generelt [19]. Det er uavklart hvordan ulike faktorer som epigenetikk, infeksjonssekveler, metabolske forstyrrelser, autoimmunitet, «nephron endowment» osv spiller inn i patofysiologien til arterionefrosklerose.
Det finnes ingen spesifikk behandling av arterionefrosklerose. Behandlinga er som ved annen generell kronisk nyresjukdom: god blodtrykkskontroll med måltrykk <140/90 mmHg (kanskje også ned mot <130/80 mmHg), adekvat antiproteinurisk behandling med ACE-hemmere eller ATII-blokkere, og aggressiv behandling av tradisjonelle kardiovaskulære risikofaktorer, som røyking, hyperkolesterolemi, overvekt, og diabetes mellitus [20].
Overlege Marius Altern Øvrehus disputerte høsten 2018: «A translational medicine approach to hypertensive nephropathy: prevalence, diagnosis, and pathophysiology”
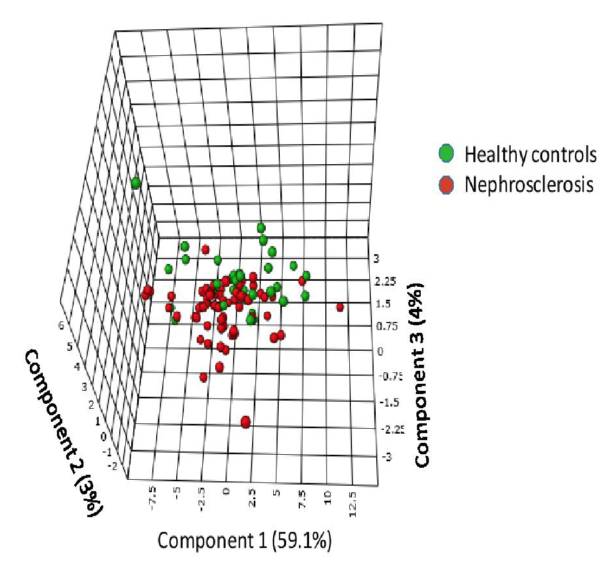
Figur 3. Evnen til urin-aminosyrer til å skille mellom tidlig nefrosklerose-pasienter (CKD stadium 2-3) og friske kontroller. PLS-DA-analyser viser variansen mellom de to gruppene, brutt ned til tre vektorer (prinsipal-komponenter 1-3). Atten aminosyrer bidrog signifikant til denne diskriminasjonen.
Copyright: MA Øvrehus.
Interessekonflikter: Holdt foredrag i regi av Otsuka Pharmaceuticals.
Referanser