Alzheimers sykdom er den vanligste årsaken til demens, og insidensen er økende grunnet økende andel eldre i befolkningen. Det finnes ingen sykdomsmodifiserende behandling, og tilgjengelig medikamentell behandling er kun symptomlindrende. Livsstilsintervensjoner midt i livet er det som hittil har vist størst risikoreduksjon.
Demens er en samlebetegnelse på en gruppe sykdommer med ulik etiologi som alle fører til kognitiv svikt. Symptomene utvikler seg oftest gradvis og er vanligvis knyttet til kortikale funksjoner som hukommelse, innlæringsevne, forståelse, vurderingsevne, tankevirksomhet, språk og orienteringsevne i tid og sted. I tillegg ser en atferds- og psykologiske (APSD eller nevropsykiatriske) symptomer, motoriske symptomer samt autonom dysfunksjon. Dette vil etterhvert føre til tap av intellektuell funksjon, redusert evne til å utføre dagliglivets aktiviteter og økende behov for hjelp.
På verdensbasis anslår en at ca. 50 millioner mennesker lider av demens, og det tilkommer nesten 10 millioner nye tilfeller i året. Antallet er forventet å øke til rundt 80 millioner i 2030 og 150 millioner i 2050. Den største økningen vil komme i lav- og middelinntektsland etterhvert som gjennomsnittsalderen øker i disse landene (1). I Norge er om lag 80 000 personer rammet av demens, men en forventer også i Norge en stor økning i forekomsten av demens i årene som kommer. Selv om demens er hyppigst forekommende hos eldre personer, anslår en at ca. 4000 personer under 65 år lever med demens i Norge i dag (2).
Omlag 35% av demenstilfellene anses forårsaket av potensielt modifiserbare faktorer som lav utdanning, hypertensjon, overvekt midt i livet, hørselstap, depresjon, diabetes, fysisk inaktivitet, røyking og sosial isolasjon (3).
“Alzheimers sykdom er den hyppigste årsaken til demens i verden, og det foreligger i dag ingen sykdomsmodifiserende behandling.”
Alzheimers sykdom (AD, forkortet etter Alzheimer’s disease) er den hyppigst forekommende demenssykdommen i verden og utgjør mellom 60-70% av tilfellene. Patofysiologisk kjennetegnes AD av avleiring av amyloide plakk ekstracellulært, utvikling av nevrofibrillære floker intracellulært (fosforylering av tau-proteiner som er en del av celleskjelettet), nevronskade, vaskulær skade og nevroinflammasjon. Nivåene av amyloid, fosforylert tau og total-tau kan måles i spinalvæsken og brukes i diagnostisk øyemed. Hos de fleste starter sykdommen i entorhinal cortex. På CT (computertomografi) eller MR (magnetresonanstomografi) av hjernen ser en initialt ofte atrofi av hippocampus i mediale temorallapper og etter hvert kortikalt og sentralt substanstap (bilde 1). Der det er tilgjengelig kan andre undersøkelser være aktuelle å utføre, spesielt hos yngre, som FDG-PET (fluor-18-merket deoksyglukose) og amyloid- (flutemetamol-)PET når spinalpunksjon ikke er mulig å gjennomføre. En anslår at de patologiske forandringene starter opp mot 10-20 år før symptomdebut. Utviklingen av nye biomarkører de siste årene gjør det derfor mulig å påvise AD forandringer i hjernen mange år før de kognitive symptomene eventuelt blir synlige.
Hos mange starter symptomene med redusert hukommelse for nylige hendelser eller samtaler (episodisk hukommelse) og problemer med tidsorientering. Etter hvert vil andre symptomer gjøre seg gjeldende. Hos de yngre kan sykdommen debutere med andre symptomer enn hukommelse, for eksempel atferdsendring, depresjon, språkvansker eller visuelle problemer.
Ved AD skjer det en reduksjon av produksjonen av flere nevrotransmittersubstanser (signalsubstanser) og en skade av reseptorene på nervesynapsene. Områdene som vanligvis rammes hardest ved AD ligger dypt i fremre del av hjernen. Blant annet den kolinerge kjernen nukleus basalis Meynert produserer mye Acetylkolin (Ach), men også temporal-, parietal-, og frontalcortex blir affisert (4). En reduksjon i Acetylkolin fører til hukommelsesvansker, redusert oppmerksomhet og noen ganger hallusinasjoner.
Det foreligger i dag ingen kurativ behandling, og ingen nye medikamenter er godkjent mot AD siden 2003. Behandlingen som er tilgjengelig, er symptomlindrende med moderat og tidsbegrenset effekt. Effekten er derimot individuell, og ved manglende effekt eller mye bivirkninger, anbefales det å prøve å skifte medikament selv om de tilhører samme medikamentgruppe. Dokumentasjonen på effekt er stort sett innhentet i kliniske utprøvinger utført av legemiddelfirmaene og er i klinisk praksis ikke alltid synlig (5). Likevel anbefales det i den nasjonale faglige retningslinjen om demens at det gjøres et behandlingsforsøk hos alle med mild til moderat AD demens(6).
Det er i dag to ulike medikamentgrupper tilgjengelig på markedet:
1. Kolinesterasehemmere (AChEI) har vært på markedet siden begynnelsen av 1990-tallet, og har vist moderat effekt ved mild til moderat AD demens. Effekten ved langtkommen demens er dårligere undersøkt, men sannsynligvis har de noe effekt også sent i forløpet (5). AChEI øker konsentrasjonen av Acetylkolin ved å redusere nedbrytningen i synapsespalten. Dette fører til en forlenget virkning på de postsynaptiske nikotinreseptorene (økt kolinerg nevrotransmisjon). I Norge er det tre AChEI på markedet, rivastigmin, donepezil og galantamin med likeverdig klinisk effekt. AChEI har ingen dokumentert effekt på mild kognitiv svikt, og det er heller ingen holdepunkter for at AChEI forsinker utviklingen av demens ved mild kognitiv svikt (3).
AChEI har vist å stabilisere eller redusere endringene i kognisjon, atferd og generell (ADL-) funksjon (7). AChEI har også vist moderat effekt på synshallusinasjoner, og dette gjelder særlig hos personer med demens ved lewylegemer. De siste årene har det vært stort fokus på å redusere bruken av psykofarmaka hos personer med demens, og AChEI blir i økende grad benyttet mot nevropsykiatriske symptomer da det er ansett å ha færre bivirkninger (8). Effekten anses derimot som moderat (9).
De vanligste bivirkningene pasientene beskriver er magesmerter, kvalme, oppkast, diare, svimmelhet, hodepine og søvnvansker. En del pasienter blir plaget med mareritt. AChEI kan gi bradykardi og forsiktighet må fremvises ved kardiale ledningsforstyrrelser.
2. Den ikke-kompetitive NMDA-reseptorantagonisten memantin er det andre medikamentet tilgjengelig på det norske markedet. Memantins antagonstiske effekt på N-metyl-D-aspartat (NMDA)- reseptoren hemmer glutaminets effekt. Glutamin virker nevrotoksisk i høye doser. Memantin har vist seg å ha moderat effekt ved moderat til alvorlig AD demens, og kan også i enkelte tilfeller brukes som tilleggsbehandling kombinert med AchEI (10). Lave doser er også en del brukt i sykehjem med effekt på nevropsykiatriske symptomer.
Utviklingen av nye legemidler kan i stor grad deles inn i tre hovedgrupper: sykdomsmodifiserende medikamenter rettet mot amyloid og/eller tau, medikamenter som skal bedre kognisjon (cognitive enhancers) og medikamenter mot nevropsykiatriske symptomer (11).
En rekke medikamenter har vært og er under utprøving, men det har ikke vært mulig å dokumentere effekt av medikamenter som aspirin, NSAIDS, steroider, østrogentilskudd, gingko biloba, vitaminer eller kosttilskudd(12).
Utviklingen av nye sykdomsmodifiserende medikamenter har vært forankret i den biologiske forståelsen av AD. De siste årene har det vært skrevet mye i media om nye lovende behandlinger, samtidig er flere utprøvinger blitt stanset pga. manglende dokumentert effekt. Noen utprøvinger som har vist positive resultater i fase 2, er fortsatt under utprøving, og de siste årene har det vært en stadig økning av nye medikamenter under utprøving (13).
Utviklingen av nye sykdomsmodifiserende medikamenter har vært rettet mot å redusere eller å forhindre dannelse av amyloide plakk (β-sekretase-inhibitorer), hindre aggregasjon eller øke nedbrytningen av amyloid (anti-amyloid immunoterapi), og forhindre fosforylering av tau (anti-tau immunoterapi) (13). Pr. 2. februar 2019 var det i USA registrert 132 ulike medikamenter under utprøving, hvorav 96 av dem var potensielle sykdomsmodifiserende medikamenter, jfr. figur 1.
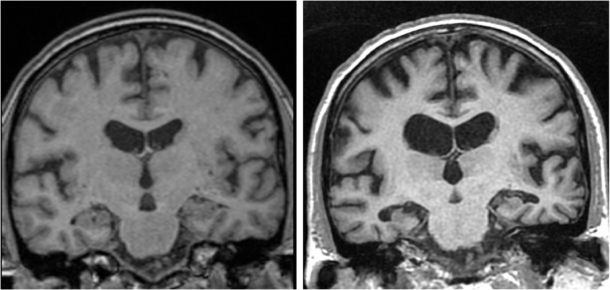
Bilde 1. Til venstre: Person med mild kognitiv svikt. MR viser begynnende forandringer i mediale temporallapper og kortikal atrofi. Til høyre: Ny MR 7 år senere hos samme person. Nå klinisk Alzheimers demens. Betydelig atrofi av mediale temporallapper (inkludert hippocampus), global kortikal atrofi og utvidet ventrikkelsystem. (Bilder: Odd Petter Eldevik, Aleris røntgen)
Majoriteten av medikamentene har vært rettet mot amyloid hvor det også har vært de mest nedslående resultatene. Dette har ført til en diskusjon om det er på tide å tenke nytt og forkaste «amyloid-hypotesen» og i stedet fokusere på kombinasjonsmedikamenter og livsstilsintervensjoner (13).
Som beskrevet over fins det i dag ingen tilgjengelige medikamenter som kan hindre eller forsinke utviklingen av AD. Pga. den lange prekliniske fasen, må en evt. sykdomsmodifiserende behandling igangsettes i preklinisk eller i svært tidlig stadium for å kunne forebygge eller utsette demensutviklingen (11). Tilgjengeligheten av nye biomarkører gir oss muligheten til å påvise AD- forandringer i hjernen på et tidlig stadium, og en risikerer å måtte behandle pasientene i flere tiår før de evt. ville fått symptomer. Samtidig vet vi at patologiske AD-forandringer er til stede i økende grad hos kognitivt friske eldre som ikke vil rekke å utvikle kognitive symptomer. Eldre har også oftere en multifaktoriell årsak til sin kognitive svikt, noe som vil medføre behov for flere medikamenter. Dette reiser viktige etiske spørsmål med tanke på overdiagnostisering, risiko for bivirkninger og komplikasjoner, og det er også et kostnadsspørsmål (14). På den andre siden vet vi at utsettelse av en demensutvikling også vil ha store samfunnsmessige konsekvenser ved at det reduserer antallet personer som lever med demens i en ikke ubetydelig grad. I tillegg vil det være av stor individuell betydning, ikke minst for de som får sin demenssykdom midt i livet.
Pr i dag er det kun forebyggende tiltak som har dokumentert effekt på reduksjon av forekomsten av demens. I de nylige publiserte anbefalingene fra verdens helseorganisasjon (WHO) for demens-risikoreduksjon, vektlegges spesielt fysisk aktivitet, røykestopp, sunt kosthold, moderat alkoholkonsum, vektreduksjon, god blodtrykkskontroll og god regulering av diabetes mellitus (15). I tillegg vet vi fra tidligere at utvikling av kognitiv reserve gjennom utdanning beskytter da det virker som en buffer mot kognitiv svikt (3).
Forfatteren har vært ansvarlig for legemiddelutprøvinger i regi av ROCHE (BN29553, Crenezumab) og Boehringer-Ingelheim (1346.0023) ved Hukommelsesklinikken, OUS.
Referanser