I tidligere artikler i Indremedisineren har vi beskrevet hvordan man praktisk kan gå frem når man skal foreta en legemiddelgjennomgang (1, 2). Vi har nylig publisert en klynge-randomisert, kontrollert, enkeltblindet studie (COOP-studien), der vi har evaluert nytten av legemiddelgjennomganger foretatt av geriater og fastlege i samarbeid for pasienter som var 70 år eller eldre og brukte sju eller flere faste legemidler. Vi vil her presentere hovedresultatene fra studien og drøfte noen praktiske implikasjoner. For nærmere detaljer viser vi til primærpublikasjonen (3).
Legemiddelforbruket hos eldre øker. Reseptregisteret viser at blant hjemmeboende i aldersgruppen 65 år eller eldre, fikk 95% minst én medisin på resept i 2017. Av disse fikk 21% utlevert 10 eller flere ulike medisiner. Andelen av kvinner i denne aldersgruppen som fikk utlevert 15 eller flere medikamenter fra apoteket økte fra 7% i 2004 til 10% i 2017, og blant mennene økte andelen fra 5% til 8% (4).
I et tidligere prosjekt fra vår gruppe studerte vi 232 pasienter innlagt ved Sykehuset i Vestfold, som var minst 75 år gamle, hadde hjemmesykepleie før innleggelsen, og som hadde tre eller flere kroniske sykdommer. 31% hadde alvorlige bivirkninger ved innleggelsen, og av disse var bivirkningen årsak til innleggelsen i halvparten av tilfellene. Det var imidlertid bare i et mindretall av tilfellene at de alvorlige bivirkningene ble forårsaket av et legemiddel som man på forhånd kunne sagt var uhensiktsmessig. De aller fleste bivirkningene ble forårsaket av legemidler som var godt indisert (5).
Multisykelighet fører til polyfarmasi, og hvert enkelt legemiddel kan ha en god indikasjon. Likevel er det et problem at legemiddellistene ofte ikke vurderes samlet. Ulike spesialister forholder seg bare til legemidler gitt for «sin» sykdom, og fastleger synes det er vanskelig å endre medikasjon som er forordnet av sykehusspesialister. Helsevesenet har mange gode rutiner som skal sikre at pasienter får de legemidlene de kan ha nytte av, men få rutiner for å sikre at indikasjonen for legemidlene blir regelmessig revurdert, og for at de blir seponert igjen når de ikke lenger trengs eller når risikoen for bivirkninger overstiger nytten. Omfanget av polyfarmasi har tiltatt raskt, og det haster derfor å etablere tiltak som kan sikre at eldre, multisyke pasienter kan få maksimal nytte av moderne farmakoterapi og samtidig minimal risiko for bivirkninger.
Det foreligger få studier på effekten av legemiddelgjennomganger. De som er gjort, har stort sett vurdert effekten på surrogatendepunkter som antall seponeringer eller antall «potensielt uhensiktsmessige forordninger» (potentially inapropriate prescriptions – PIPs). En reduksjon i antall legemidler eller antall PIPs er imidlertid ikke ensbetydende med at pasienten har hatt reell nytte av legemiddelendringene.
Vi ønsket derfor å evaluere effekten av legemiddelgjennomganger på kliniske endepunkt. Vi postulerte at legemiddelgjennomgang av geriater og fastlege i samarbeid kunne være nyttig. Geriateren har spisskompetanse i farmakoterapi til eldre, mens fastlegen kjenner pasientens medisinske historie, skal følge pasienten videre, og har det medisinske ansvaret så lenge pasienten er hjemmeboende.
Vi rekrutterte fastleger fra Oslo og Akershus, som hver kunne delta med 1-5 pasienter fra sine lister. Fastlegene, med sine inkluderte pasienter, ble randomisert til intervensjons- eller kontrollgruppen.
Intervensjonen hadde tre deler:
1. Klinisk undersøkelse av pasienten, inkludert gjennomgang av alle legemidler med vurdering av indikasjon, effekt, mulige bivirkninger og interaksjoner. EKG og standard blodprøver inngikk, inkludert serumkonsentrasjonsmålinger der det var relevant, samt farmakogenetiske analyser.
2. Et møte mellom geriateren og fastlegen, hvor man gikk gjennom legemiddellisten i fellesskap. Geriateren kunne foreslå legemiddelendringer, men det var opp til fastlegen å velge om rådene skulle etterfølges eller ikke.
3. Klinisk oppfølging av pasienten ut fra en avtalt ansvarsfordeling. I de fleste tilfellene var det fastlegene som stod for dette.
Hovedeffektmålet var indeks-skår på livskvalitetsinstrumentet 15D etter 16 uker. Dette instrumentet kartlegger pasientens subjektive helse, symptomer og funksjon innen områdene mobilitet, syn, hørsel, pust, søvn, spising, snakking, vannlating/avføring, vanlige aktiviteter, mental funksjon, ubehag/symptomer, depresjon, stress/angst, vitalitet og seksuell aktivitet. Vi anså et slikt bredt instrument som hensiktsmessig for å fange opp eventuelle kliniske effekter av en intervensjon som kunne berøre mange ulike legemiddelklasser og legemidler gitt på mange ulike indikasjoner. 15D indeks-skår går fra 0 til 1, der høyere verdi angir bedre livskvalitet. En endring på 0,015 eller mer regnes som klinisk relevant, mens en endring på 0,035 eller mer regnes som «mye bedre/verre». I tillegg hadde vi en rekke sekundære endepunkter knyttet til fysisk funksjon, kognitiv funksjon, forbruk av helsetjenester, pårørendebelastning og overlevelse.
36 fastleger med til sammen 87 pasienter ble randomisert til intervensjonsgruppen, og 34 fastleger med 87 pasienter til kontrollgruppen. 84 intervensjonspasienter og 79 kontrollpasienter var fortsatt med etter 16 uker. Gjennomsnittlig 15D-skår forverret seg i begge gruppene, men betydelig mindre i intervensjonsgruppen. Justert for ulikheter på baseline var forskjellen etter 16 uker 0,045 (95% konfidensintervall [KI] 0,004 til 0,086). Etter 24 uker økte forskjellen ytterligere, jf. Figur 1.
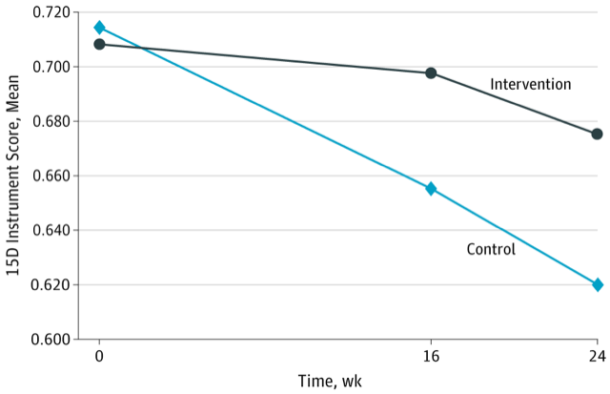
Figur 1. Utvikling i skåre på livskvalitetsskalaen 15D i hhv. intervensjons- og kontrollgruppen. Gjengitt fra (3) med tillatelse fra American Medical Association
Justert for ulikheter på baseline var forskjellen etter 16 uker 0,045 (95% konfidensintervall [KI] 0,004 til 0,086). Etter 24 uker økte forskjellen ytterligere. 48% i intervensjonsgruppen mot 22% i kontrollgruppen oppnådde en klinisk signifikant bedring i 15D-skår (p=0,004). Det var også en trend i retning av bedre resultater på fysiske og kognitive mål i intervensjonsgruppen, jf. tabell 1.

KI = konfidensintervall
* Negativt tall betyr raskere utføring av testen
I løpet av total oppfølgingstid på 24 uker døde tre pasienter i intervensjonsgruppen og sju i kontrollgruppen. Denne forskjellen var ikke statistisk signifikant (justert oddsforhold [OR] 0,36, 95% KI 0,08 til 1,58). Vi fant ingen effekt på ortostatisk blodtrykk, fall, pårørendestress, ADL-funksjon eller bruk av hjemmesykepleie eller sykehjem. Det var en trend i retning av flere sykehusinnleggelser i intervensjonsgruppen (justert OR 2,03, 95% KI 0,98 til 4,24).
Blant 84 pasienter i intervensjonsgruppen ble det seponert 224 og doseredusert 84 legemidler, mens det blant 79 pasienter i intervensjonsgruppen ble seponert 56 og doseredusert 18. Tilsvarende tall for nyforordninger var 109 i intervensjonsgruppen og 50 i kontrollgruppen, og for doseøkninger 38 i intervensjonsgruppen og 29 i kontrollgruppen. Både seponeringer/ dosereduksjoner og nyfordninger /doseøkninger skjedde hyppigst i legemiddelgruppene hjerte-kar-midler, midler med effekt på mage-tarm, analgetika, psykofarmaka og antitrombotiske midler.
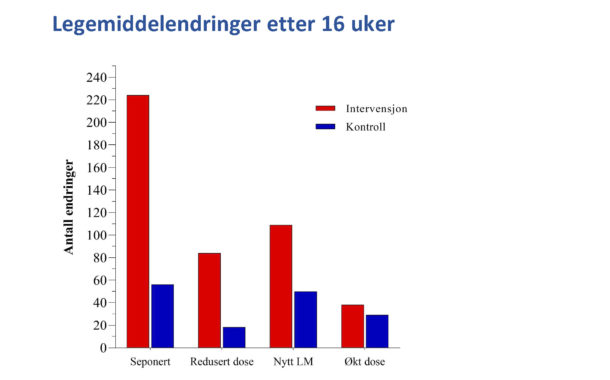
Figur 2
Vi antar at fastleger som ønsker å delta i et slikt prosjekt er blant de som er mest interessert i legemiddelbruk hos eldre – og som dermed trolig også har mye kunnskap om temaet, og en aktiv holdning til å optimalisere legemiddelbruken. Pasientene hadde tidligere fått gjennomført legemiddelgjennomganger slik det nå er forskriftsfestet for alle som bruker fire eller flere legemidler, de var stabile, og det var ikke spesiell bekymring for deres legemiddelbruk. Likevel førte altså introduksjon av geriatrisk kompetanse til at det ble seponert eller doseredusert i snitt 3,6 legemidler per pasient og nyforordnet eller doseøkt 1,8 legemidler per pasient, med klinisk betydningsfull og statistisk signifikant effekt på livskvalitet, fysisk og kognitiv funksjon. Dette illustrerer at legemiddelgjennomganger ved uttalt polyfarmasi er medisinsk komplisert og hviler tungt på indremedisinsk kompetanse, fordi en stor andel av legemidlene er gitt på en indremedisinsk indikasjon.
Fastlegene kunne altså velge å følge geriaterens råd, eller la det være. Vi har foreløpig ikke eksakte tall for dette, men vet at det var mange av geriaterens vurderinger som ikke ble fulgt opp. Det kan tenkes at effekten av intervensjonen ville blitt enda større dersom geriateren selv hadde fulgt pasientene tettere opp, men det kan også tenkes at fastlegen var en sunn «brems» mot råd som det ikke ville vært bra å følge.
Få pasienter brukte legemidler som generelt kan regnes som «uegnet». Man får derfor begrenset effekt ved bare å screene pasientenes medisinlister med fortegnelser over «potensielt uegnede legemidler». De samme legemiddelklassene dominerte både blant legemidler som ble seponert eller doseredusert og blant legemidler som ble nyforordnet eller doseøkt. Seponeringer, nyforordninger og dosejusteringer hvilte tungt på en tilstrekkelig grundig klinisk vurdering av pasienten. I mange tilfeller var dette tidkrevende. I en hverdag hvor de akutte problemstillingene ofte må prioriteres, er det utfordrende både for fastleger og sykehusleger å kunne sette av nok tid til å fordype seg i medisinlistene. Forsøk på å lage snarveier for opprydning i polyfarmasi som ikke omfatter en klinisk vurdering og systematisk evaluering av hvert enkelt legemiddel, vil imidlertid ha liten sjanse til å gi klinisk gevinst.
Intervensjonen førte alt i alt til en mindre intensiv farmakoterapi, men også mer enn dobbelt så mange nyforordninger som i kontrollgruppen. Det blir derfor alt for enkelt å tro at ved polyfarmasi hos eldre er det om å gjøre å seponere så mye som mulig. Snarere har vi vist effekt av en aktiv holdning til optimalisering av den samlede legemiddellisten – styrt av kompetanse og tilstrekkelig oversikt over pasientens kliniske tilstand. Vi tror også den direkte kommunikasjonen mellom geriater og fastlege bidro til å gjøre vår intervensjon effektiv. Direkte drøfting er mer effektivt for å utnytte legenes komplementære kompetanse enn utveksling av henvisninger og epikriser. Helseforetakene har en lovfestet plikt til å drive veiledning av primærhelsetjenesten, og fastleger kan skrive takst for drøfting med sykehuslege. Vi tror dette er nyttig bruk av tid, men det krever koordinering av de to legenes timeplaner. På grunn av tidsbruken anbefaler vi dette hovedsakelig for de mest komplekse pasientene.
Studien viser altså at det er stort potensiale for å optimalisere legemiddelbruken hos eldre som bruker mange medisiner, selv når de er i en stabil klinisk situasjon og følges av en dyktig og interessert fastlege. Vår modell testet ut et samarbeid mellom geriater og fastlege, noe vi tror vil være nyttig å implementere i form av en type «polyfarmasipoliklinikk». For å hanskes med utfordringene knyttet til stadig økende legemiddelbruk hos skrøpelige eldre er det imidlertid avgjørende at alle leger, både i primærhelsetjenesten og på sykehus, forstår hvor store konsekvenser uheldig medisinering kan ha – og lar seg inspirere til å brette opp ermene og fordype seg i de lange medisinlistene! Man må ikke ta noe legemiddel «for gitt», men vurdere hvert enkelt middel på listen kritisk med tanke på nytteverdi, dosering, mulige bivirkninger og interaksjoner. Likeledes må man for hver pasient tenke nøye gjennom om det er ett eller flere legemidler pasienten kunne hatt nytte av, men ikke har fått. Når man har opparbeidet seg erfaring i å gjøre systematiske legemiddelgjennomganger går det etter hvert raskere, og det er givende og faglig stimulerende legearbeid.
Referanser