Ingvild Kristine Blom-Høgestøl, LIS, Avdeling for endokrinologi, sykelig overvekt og forebyggende medisin, OUS Aker
Osteoporose eller benskjørhet gir økt risiko for benbrudd. Hva som skiller et osteoporotisk brudd fra et ikke-osteoporotisk brudd og hvem som er i risiko gruppen for disse? Denne teksten har som mål å gå gjennom disse spørsmålene samt gi en enkel innføring i hva bentetthet er, og ikke er.
I 1993 ble osteoporose definert som en systemisk sykdom i skjelettet, karakterisert av lav benmasse og mikroarkitektonisk nedbrytning av benvev som fører til økt benfragilitet og økt frakturrisiko (1). Osteoporotiske brudd er den kliniske konsekvensen av osteoporose, og de er ofte omtalt som fragilitetsbrudd eller lavenergibrudd. Disse bruddene er et resultat av et lavenergitraume, det vil si et fall fra egen høyde eller mindre, som normalt sett ikke ville ledet til et benbrudd. De vanligste osteoporotiske bruddene er kompresjonsbrudd av ryggvirvler (videre omtalt som kompresjonsbrudd) og brudd i lårhals, proksimale humerus samt distale radius, men de kan forekomme i hele skjelettet. Slike brudd er vanlig forekommende. I følge Folkehelseinstituttet vil annenhver kvinne og hver fjerde mann gjennomgå et osteoporotisk brudd i sin levetid. Osteoporotiske brudd forekommer over hele verden, men det ser ut som det er regionale forskjeller. Så mange som en tredjedel av alle osteoporotiske brudd skjer i Europa og de skandinaviske landene ligger høyt på statistikkene (2). Også Nord-Amerika har en høy forekomst, hvor det viser seg at personer med nordeuropeisk opprinnelse har spesielt høy risiko (3).
En hjørnesten for å estimere risiko for benbrudd er måling av benmineraltetthet (videre forenklet til bentetthet), i rygg og hofte. Bentetthet blir målt med en Dual Energy X-ray (DXA) maskin. En DXA-måling er relativt enkel og billig, med lav stråledose. For å forstå svaret til en DXA-måling trenger vi å forstå prinsippet som ligger til grunn for en T-skår.
En T-skår indikerer hvor mange standarddeviasjoner en observasjon avviker fra gjennomsnittet. Standarddeviasjonene er et utrykk for variasjonen fra gjennomsnittsverdien, figur 1. En DXA-måling kvantifiserer benmasse som antall gram mineral per areal (cm2). For å lage en T-skår sammenligner maskinen observasjonen med en referansepopulasjon med unge friske kvinner. Slik vil T-skåren du leser av i DXA-målingen representere antallet standarddevisjoner denne bentettheten avviker fra den gjennomsnittlige bentettheten til unge friske kvinner.
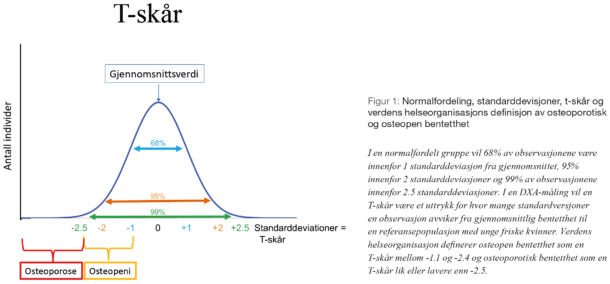
I 1994 lagde verdens helseorganisasjon diagnosekriterier basert på T-skår. Osteoporose ble her definert som en T-skår lik eller lavere enn -2.5, og osteopeni ble definert som en T-skåre mellom -1.1 og -2.4. Disse diagnoseIngvild kriteriene baserer seg på den sterke sammenhengen mellom bentetthet og frakturrisiko. For hver standarddeviasjons reduksjon i bentetthet, øker frakturrisikoen 1.5 til 2.5 ganger (4). En T-skår predikerer frakturrisiko for både menn og kvinner, selv om referansepopulasjonen kun består av kvinner. Videre predikerer den risiko for både lav- og høyenergibrudd, selv om sammenhengen med lavenergibrudd er best beskrevet. Med andre ord er bentetthet, ofte uttrykt som en T-skår, en viktig risikofaktor for osteoporotiske brudd for både menn og kvinner.
Det enkle svaret på dette er ja. Grunnen er at flertallet av osteoporotiske brudd skjer hos personer som har osteopeni. Dette kom frem av den amerikanske studien National Osteoporosis Risk Assessment Study – NORA (5). Her ble nærmere 150 000 hvite, middelaldrende, postmenopausale kvinner undersøkt med bentetthetsmåling, og deretter fulgt i ett år hvor de rapporterte inn frakturer. Studien bekreftet en klar sammenheng mellom lav bentetthet og høy frakturrisiko. Gjennomsnittlig t-skår i populasjonen var -1.2. Til tross for at risikoen for brudd var høyest hos kvinnene med lavest bentetthet, var det totalt sett flere osteoporotiske brudd i gruppen som hadde osteopen bentetthet (T-skår -1.1 til -2.4). Forklaringen ligger i at osteopen bentetthet var langt vanligere enn osteoporotisk bentetthet (t-skår ≤ -2.5). Studien illustrerte et sentralt poeng, at vi trenger å vurdere andre risikofaktorer i tillegg til bentetthet for å predikere flertallet av osteoporotiske brudd.
Risikoen for brudd øker med alder. Fra 50 års alder dobler bruddrisikoen seg hvert femte til tiende år. Denne sammenhengen ses særlig for lårhalsbrudd og kompresjonsbrudd i ryggen. Så mange som 90% av alle lårhalsbrudd skjer etter fylte 50 år. En 80 år gammel kvinne vil ha en 25 ganger høyere risiko for lårhalsbrudd, sammenlignet med en 55-åring (6).
I 1941 beskrev Fuller Albright at av sine 42 pasienter med osteoporotiske brudd før 65 års alder, var 40 kvinner som hadde gått i tidlig menopause eller hadde fjernet eggstokkene. Basert på dette funnet beskrev han den sentrale link mellom østrogenmangel og osteoporotiske brudd. Det er en klar kjønnsforskjell i bruddforekomst. I den yngre delen av befolkningen er det menn som pådrar seg de fleste bruddene, og i denne aldersgruppen er hovedvekten av bruddene et resultat av høyenergitraumer. Etter fylte 50 år er det et skifte, og de fleste bruddene skjer hos kvinner med et flertall av lavenergibrudd, altså osteoporotiske brudd. Hos denne gruppen er risikoen for brudd dobbelt så høy for kvinner sammenlignet med menn. Østrogenmangelen etter menopausen ses på som en sterk driver bak dette skiftet. Sen menarche, etter 16 års alder, og tidlig menopause, før 45 års alder, er begge viktige risikofaktorer for osteoporotiske brudd blant kvinner.
Tidligere benbrudd øker risikoen for å pådra seg et nytt brudd. I Tromsøundersøkelsen fant de at etter et brudd, har kvinner 1,3 ganger høyere risiko for et nytt brudd, og for menn er risikoen doblet. Videre fant de at jo flere tidligere brudd, jo høyere er risikoen for neste brudd, og at et proksimalt brudd, som for eksempel humerus- eller lårhalsbrudd, er forbundet med enda høyere risiko for neste brudd (7). Kun ca. 20% av alle kompresjonsbrudd gir kliniske symptomer. Derfor er de ofte tilfeldige funn ved røntgenundersøkelser, eller ses på det laterale bildet på DXA-målingen, figur 2. Sammenhengen mellom denne typen brudd og fremtidige brudd ble illustrert i den Canadiske multisenter osteoporosestudien – CaMos. De målte bentetthet og tok sidebilde for å kartlegge forekomst av kompresjonsbrudd, og fulgte deltakerne i fem år. De fant at personer med kompresjonsbrudd hadde en fordoblet frakturrisiko (8).
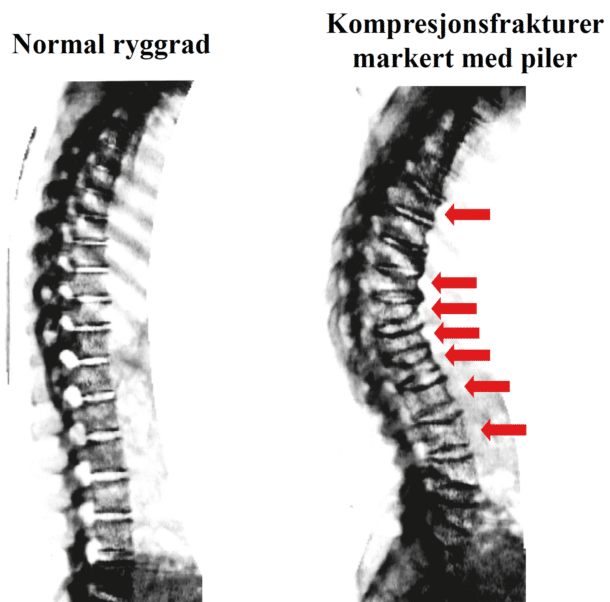
Figur 2: Kompresjonsfrakturer i ryggvirvler sett i lateral bildet til DXA-målingen.
For eksempel hadde en 50-åring med en bentetthet t-skåre -2.0 og et kompresjonsbrudd en sammenlignbar frakturrisiko som en 65-åring med en bentetthet t-skåre -3.0 uten kompresjonsbrudd. I Norge viste Tromsøunderøkelsen en forekomst av slike brudd på 14% hos menn og 12% hos kvinner i den generelle befolkningen (9), og hos 35% av personer som søker behandling for et annet brudd (10).
Vitamin D er viktig for skjelettet, og mangel på vitamin D er eksponentielt relatert til osteoporotiske brudd. Vi ser en økning i frakturrisikoen når 25-OH vitamin D faller under 50 nmol/L, og 25-OH vitamin D-nivåer under 12.5 nmol/L er forbundet med en 50% økning i frakturrisikoen (11). Alvorlig vitamin D mangel er slik en risikofaktor for osteoporotiske brudd. Kalsium er en sentral byggestein i skjelettet og et essensielt mineral, som også er viktig for muskelkontraksjon. For høye eller for lave konsentrasjoner av kalsium er livsfarlig, og kalsiumverdiene i blodet er strengt regulert. Av denne grunn er kalsiumnivået i blod en dårlig markør for frakturrisiko. Om kalsiumtilskudd minker risikoen for osteoporotiske brudd er omdiskutert, studiene er mange og motstridende, men samlet sett er det lite dokumentasjon for at kalsiumtilskudd alene reduserer risikoen. En Cochrane-gjennomgang konkluderte i 2014 med at vitamin D og kalsiumtilskudd kan forebygge brudd i den eldre delen av befolkningen (12).
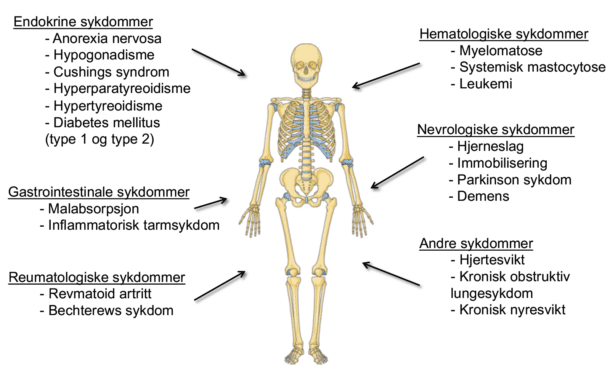
Figur 3: Eksempler på sykdommer som er forbundet med økt risiko for osteoporotiske brudd.
Menn som er høyere enn 179 cm har 70% høyere risiko for å pådra seg et osteoporotisk brudd sammenlignet med menn som er lavere enn 172 cm. Kvinner som er høyere enn 167 cm har 60% høyere risiko sammenlignet med kvinner som er lavere enn 160 cm (13). Trolig er forklaringen på dette at skjelettet tilpasser seg til høyden ved å anlegge knoklene bredere, med en videre benmargskanal og en relativt sett tynnere benkorteks med mer porøsitet i det kortikale benet. Trolig er dette for å unngå at skjelettet ikke skal bli for tungt (14).
Flere livsstilsfaktorer spiller inn på risikoen for osteoporotiske brudd. Blant disse er en sedat livsstil, usunn kost, høyt alkoholforbruk og røyking alle forbundet med økt risiko for lavenergibrudd. Generelt er et sunt kosthold og regelmessig fysisk aktivitet forbundet med god benhelse. På den andre siden er ekstrem fysisk aktivitet, lavt energiinntak og undervekt også risikofaktorer for osteoporotiske brudd.
En rekke andre sykdommer kan påvirke skjelettet og medføre økt frakturrisiko. Noen sentrale er illustrert i figur 2. Optimalisering av primære tilstand er viktig for å begrense den negative effekten på skjelettet. I senere år har den økte frakturrisikoen hos personer med diabetes, og kanskje særlig type 2, fått mye oppmerksomhet. Bakgrunnen er at insulin (som jo er høyt hos de fleste personer med type 2 diabetes) er anabolt for skjelettet, og at personer med type 2 diabetes typisk har høy bentetthet og lav benomsettning – to faktorer som tradisjonelt er forbundet med lav frakturrisiko. Den fulle forklaringen på hvorfor personer med type 2 diabetes har høyere risiko for brudd er ikke kjent, men teoriene mange. Dette nevnes fordi det understreker viktigheten av en full anamnese for å vurdere en persons risiko for osteoporotiske brudd.
Fall er den vanligste skademekanismen for osteoporotiske brudd, og økt falltendens er en klar risikofaktor. Derfor er det viktig å kartlegge, og potensielt motvirke, forhold som kan øker fallfaren. Monogenetiske former for osteoporose finnes, men er sjeldne. Etiologien bak osteoporotiske brudd er ikke fullstendig forstått, men sannsynligvis er det en kombinasjon av miljøfaktorer og polygenetikk. Store hel-genom studier estimerer at frakturrisiko har en arvelighet på 25-30%. Familiehistorikk en viktig del av kartleggingen for å avgjøre frakturrisiko. For eksempel er det vist at datteren av en kvinne med et lårhalsbrudd vil ha en doblet risiko for osteoporotiske brudd (15).
I Norge ble de nasjonale retningslinjene for forebygging og behandling av osteoporotiske brudd publisert i 2005, før skåringsverktøy for risikofaktorer for osteoporotiske brudd var tilgjengelig. Retningslinjene er derfor basert på Verdens helseorganisasjons (WHO) retningslinjer fra 1994 (16), som anbefaler at postmenopausale kvinner med osteoporotisk bentetthet (t-skår ≤ -2.5) eller med brudd og osteopen bentetthet (t-skår -1.1 til -2.4), bør tilbys medikamentell bruddforebyggende behandling (også omtalt som anti-osteoporotisk behandling). Videre tilføyes det at det kan gjøres individuelle tilpasninger for individer med flere risikofaktorer. I en klinisk setting kan det være vanskelig å avgjøre hvilke pasienter som omfattes av den siste setningen.
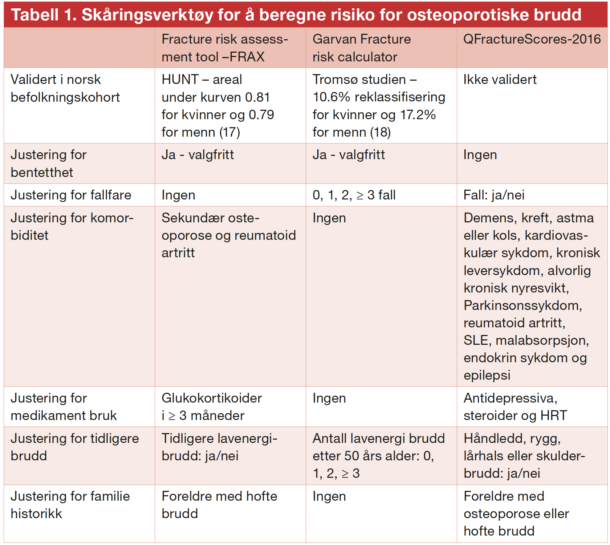
I nyere tid er det kommet flere nyttige skåringsverktøy for å beregne risiko for osteoporotiske brudd. De mest kjente er Fracture risk assessment tool – FRAX, QFracture-2016 og Garvan Fracture risk calculator. Alle er enkelt og gratis tilgjengelig på nett. I tabell 1 oppsummeres styrker og svakheter ved de ulike skåringsverktøyene. Det internasjonale osteoporoseforbundet anbefaler at FRAX brukes som verktøy for å avgjøre hvilke individer som skal tilbys medikamentell bruddforebyggende behandling. De anbefaler at individer som har en 10 års risiko for større osteoporotisk brudd ≥ 20% eller en risiko for lårhalsbrudd ≥ 3% får dette tilbudet. Disse anbefalingene ble også nylig inkorporert i svenske nasjonale anbefalinger.
Et benbrudd som følge at et lavenergitraume som ellers ikke ville ført til brudd, eller i fravær av traume, er et osteoporotisk brudd. Lav benmineraltetthet, høy alder, kvinnelig kjønn og tidligere brudd er de viktigste risikofaktorene for osteoporotiske brudd. En osteoporotisk bentetthet (t-skår ≤ -2.5) er ikke en forutsetning for at et benbrudd skal klassifiseres som et osteoporotisk brudd, faktisk ses flertallet av osteoporotiske brudd hos individer med osteopen bentetthet (t-skår -1.1 til -2.4). De ulike skåringsverktøyene muliggjør en rask og enkel risikovurdering, og er internasjonalt brukt for å selektere hvilke pasienter som bør tilbys effektiv medikamentell bruddforebyggende behandling.
Innlegget er basert på prøveforelesning for PhD graden