Vi har sett mange pasienter med bivirkninger av amiodaron. Tall fra Reseptregisteret viser at forskrivning av amiodaron i Norge har økt betydelig de siste 10 årene. Artikkelen omtaler også praktisk bruk av amiodaron med hensyn til farmakologiske egenskaper, de vanligste bivirkningene, og kontrollrutiner ved langtidsbruk. Vi finner det bekymringsfullt at bruk av amiodaron for atrieflimmer er sterkt økende.
Ole-Gunnar Anfinsen (1), Kari Lima (2), Mohammad Nouri Sharikabad (3)
1: Overlege dr.med., Arytmiseksjonen, Kardiologisk avdeling, Oslo universitetssykehus Rikshospitalet
2: Overlege Ph.d., Endokrinologisk avdeling, Medisinsk divisjon, Akershus universitetssykehus
3: Avdelingsdirektør, Dr.philos. cand.pharm., Avdeling for legemiddelstatistikk, Folkehelseinstituttet
Korresponderende forfatter: Ole-Gunnar Anfinsen. E-post: oanfinse@ous-hf.no

Vi har i egen klinisk praksis blitt involvert i et økende antall pasienter med amiodaron-indusert tyreotoksikose, og ønsket derfor å undersøke forbruket av amiodaron i Norge, hvilke indikasjoner som var de hyppigste, og om det var noen endring over tid. Amiodaron (Cordarone®) er det mest potente medikamentet vi har mot hjerterytmeforstyrrelser, men er et preparat med hyppige bivirkninger som kan ramme forskjellige organsystemer. Amiodaron kan benyttes mot livstruende ventrikulær arytmi for å hindre anfall og redusere faren for innslag fra en implantert defibrillator (ICD). Det kan også benyttes hos pasienter med invalidiserende atrieflimmer for å bevare normal sinusrytme (rytmekontroll) dersom andre medikamenter ikke har tilstrekkelig effekt eller ikke kan benyttes.
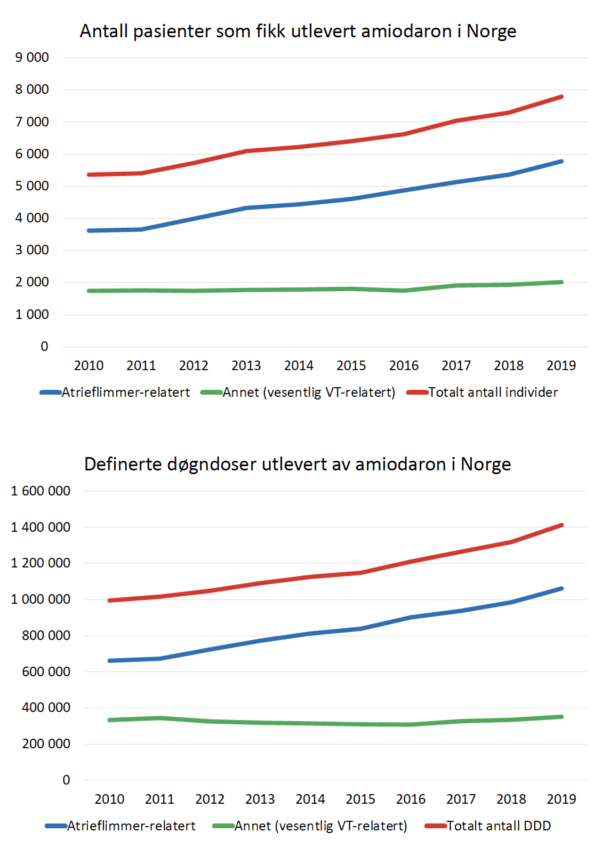
Fra Reseptregisteret har vi innhentet antall personer som årlig har fått utlevert amiodaron og antall utleverte definerte døgndoser (DDD), fordelt på ulike refusjonskoder. Vi har slått sammen utleveringskategoriene ICD-10 i48 og ICPC K78, som omfatter paroksysmal og persisterende atrieflimmer samt typisk og atypisk atrieflutter, og kalt dette «Atrieflimmer-relatert indikasjon». Videre har vi slått sammen kategoriene i47/K79 og i49/K80, som når det gjelder amiodaron overveiende dreier seg om ventrikkeltakykardi (VT) eller ventrikkelflimmer, og kalt dette «Vesentlig VT-relatert indikasjon». I gruppen i47/K79/i49/K80 inngår nok også enkelte pasienter med eksempelvis medfødt hjertefeil og atrietakykardi eller andre supraventrikulære takykardier, men vi antar at dette er et lite antall.
Fra 2010 til 2019 økte antall individer som fikk amiodaron på apotek i Norge fra 5359 til 7789 (45 % økning), og totalt antall DDD fra 994905 til 1412796 (42 % økning) (Figur 1 a og b). Med atrieflimmer-relatert refusjonskode fant vi i samme periode økning av antall individer fra 3616 til 5776 (60 % økning) og antall DDD fra 661531 til 1061601 (60 % økning) (Figur 1 a og b). I 2010 ble 66 % av DDD utlevert fra apotek knyttet til atrieflimmer-relaterte diagnoser, mens andelen i 2019 utgjorde 75 %.
Forbruket av amiodaron i Norge har økt med 42-45 % gjennom de siste 10 år, og økningen skyldes nesten utelukkende atrieflimmer-relaterte diagnoser. VT-relatert forbruk av amiodaron har vært tilnærmet uendret gjennom perioden. Mengden amiodaron utlevert på atrieflimmerrelatert refusjonskode har økt med 60 % fra 2010 til 2019, og andelen av total amiodaron-forbruk som går til atrieflimmer har økt fra 66 % til 75 %. Til sammenligning har antallet forskrivninger av amiodaron i USA i perioden 2008 til 2018 vært tilnærmet konstant (1). I USA er amiodaron tabletter ikke FDA-godkjent til rytmekontroll av atrieflimmer, men preparatet brukes likevel hyppig på denne indikasjonen (2).
Prevalensen av atrieflimmer øker pga. alderssammensetning i befolkningen og livsstilsrelaterte risikofaktorer (3). Vi tror likevel ikke at prevalensøkningen av atrieflimmer alene er tilstrekkelig til å forklare 60 % økning i bruk av amiodaron foreskrevet på atrieflimmer-relatert indikasjon i løpet av 10 år. Det har sannsynligvis skjedd en dreining av indikasjonsstilling eller behandlingsmål.
Økningen i amiodaron-bruk skjer samtidig som mange flere pasienter behandles med kateterablasjon særlig for atrieflimmer. Flere ønsker rytmekontroll heller enn frekvenskontroll. Fra henvisningsskriv registrerer vi at amiodaron brukes en del for å holde pasientene mest mulig i sinusrytme frem til ablasjon. Dette kan være begrunnet både i symptomlindring og ønske om å motvirke atrieflimmer-mediert remodellering av atriemyokard («atrial fibrillation begets atrial fibrillation») (4).
Indikasjonen for bruk av amiodarone til langtids rytmekontroll ble nylig oppgradert i guidelines fra European Society of Cardiology. Tidligere var det anbefaling klasse IIa, evidensnivå C, men fra 2020 har det blitt klasse I, evidensnivå A, riktignok fortsatt med presisering av at man pga. bivirkningsprofil bør vurdere andre antiarytmika først (3). Fra henvisningsskriv får vi inntrykk av at noen kolleger er veldig bevisste på relative kontraindikasjoner mot flekainid og dronedaron, men ikke like opptatt av at amiodaron kan være minst like problematisk hos de samme pasientene. Det er betenkelig dersom oppgradering av anbefalingen for bruk av amiodaron medfører lavere terskel og økt bruk av dette medikamentet.
Amiodaron ble lansert i 1967 som et antianginøst medikament med nonnitrat vasodilaterende egenskaper (5) og betablokker-effekt. De antiarytmiske egenskapene ble påvist og kartlagt på 70-tallet. Preparatet virker i hovedsak via kaliumkanaler og gir forlengelse av repolariseringsfasen av aksjonspotensialet (klasse III-effekt). Men amiodaron er en multikanal-hemmer som også påvirker ledningshastighet (klasse Ieffekt), har en viss betablokkereffekt og en svak kalsiumantagonistisk effekt. Preparatet har minimal negativ inotrop virkning og lavt proarytmisk potensial. Praktisk bruk og bivirkningsprofil av amiodaron er omtalt i flere oversiktsartikler (6–8), og vi vil her gi en kort oppsummering.
Amiodaron er lipofilt og lagres i fettvev. Det metaboliseres og utskilles i hovedsak via leveren, mens den renale utskillelsen er liten (<10 %). Terapeutisk effekt gjenspeiles i liten grad av plasmanivå. Ved start av behandling må det gis en metningsdose på 600-1200 mg per døgn til totalt 10-14 g, gjerne over 2-3 uker. Deretter titrerer man seg ned til laveste effektive vedlikeholdsdose, som ofte ligger rundt 200 mg per døgn, men kan variere mellom 50 og 400 mg. Ved kronisk behandling regner man halveringstid ca. 50 dager med variasjon mellom 20 og 100 dager, og det kan være klinisk effekt i 3-4 måneder etter avsluttet behandling.
Amiodaron kan ha kardiovaskulære bivirkninger i form av sinusbradykardi, AV-overlednings-forstyrrelser og forlenget QT-tid. Fordi det er en multikanalhemmer, ses torsades de pointes-arytmi sjeldnere enn ved en del andre QT-forlengende medikamenter. Ved rask intravenøs infusjon kan man oppleve blodtrykksfall relatert til de vasodilaterende egenskapene til amiodaron i seg selv og til løsningsmiddelet polysorbat (7).
Ekstrakardiale bivirkninger ved bruk av amiodaron er knyttet dels til det høye jodinnholdet, dels til at amiodaron danner komplekse forbindelser med fosfolipider. Disse kompleksene kan lagres i forskjellige organer og gi skadelige effekter. Det angis at ca. 10 % av amiodaronbehandlete pasienter per år må avslutte behandlingen pga. ekstrakardiale bivirkninger (7). Selv om amiodaron benyttes mot livstruende arytmier, har man i studier ikke funnet noen mortalitetsreduksjon ved bruk av preparatet ved hjertesvikt eller ventrikulær arytmi.
De hyppigste bivirkningene er knyttet til hudforandringer, og varierer fra fotosensitivitet og solbrenthet til kløende erythem og hyperpigmentering (blågrå misfarging). Alle pasienter får råd om å unngå sterk sol og bruke solbeskyttelse med klær og/eller solkrem med høy solfaktor. Hudforandringene er vanligvis reversible etter seponering, men kan vare 6-24 måneder (7).
En vanlig vedlikeholdsdose på 200 mg amiodaron inneholder tilsvarende 6 mg fritt jod. Anbefalt inntak av jod i kosten er 50-150 mikrogram daglig avhengig av alder (9). I områder med tilstrekkelig jodinnhold i kostholdet er amiodaronindusert hypotyreose vanligst, mens det i områder med jodmangel ses hyppigere amiodaron-indusert hypertyreose (AIT) (10). Det er to hovedtyper av AIT. Type I skyldes økt syntese av tyreoidea-hormon, mens type II skyldes økt frigjøring (lekkasje) fra follikkelcellene pga. destruktiv tyreoiditt. Prevalens er 3-5 % av pasienter behandlet med amiodaron i områder med tilstrekkelig jod-inntak (10), og risiko øker med kumulativ amiodaron-dose. Tyreotoksikosen kan komme tidlig etter oppstart eller etter langvarig bruk, og kan også oppstå flere måneder etter seponering av legemidlet.
Nesten alle som bruker amiodaron får mikroavleiringer i hornhinnen som er synlige med spaltelampe. Dette påvirker vanligvis ikke syn eller akkomodasjonsevne, men kan gi irritasjon i øynene, lysømfintlighet og fargeforandringer (halofenomen) i motlys. Plagene lindres ved dosereduksjon og ev. kunstig tårevæske (8). Opticus-nevropati er en svært sjelden bivirkning av amiodaron.
Noen får kvalme og oppkast, eller asymptomatisk transaminasestigning som uttrykk for lettgradig leverpåvirkning. Opptil dobling av ASAT og ALAT kan vanligvis aksepteres, men enzymstigning utover dette må utredes for mulig annen bakenforliggende leversykdom (6). Uttalte leverfunksjonsforstyrrelser med hepatitt, kolestase eller cirrhose er relativt sjelden forårsaket av amiodaron.
Den mest fryktede komplikasjonen til amiodaron-bruk er lungefunksjonsforstyrrelser pga. interstitiell pneumonitt og fibrose. Dette er heldigvis sjelden så lenge man bruker lave doser, men annen samtidig lungesykdom kan øke faren. Det anbefales årlig kontroll rtg. thorax med tanke på dette (6,7), men like viktig er anamnese med oppmerksomhet på hoste eller økende pustebesvær. Høyoppløselig CT av lungene og måling av CO diffusjonskapasitet brukes ved mistanke om pulmonale bivirkninger.
Amiodaron kan også gi bivirkninger fra nervesystemet i form av polynevropati, tremor, hodepine og søvnforstyrrelser.
Preparatvedlegget med listen over bivirkninger er ofte skremmende for pasientene, men det er ikke uten grunn. Man bør være restriktiv med bruk av medikamentet, og bare benytte det ved invalidiserende arytmier når alle andre alternativ virkelig er dårligere. Det kreves systematisk oppfølging av alle som bruker amiodaron fast. EKG, TSH, fritt T4, fritt T3, ASAT og ALAT bør tas ved oppstart og senere minst hvert halvår. Man må være oppmerksom på luftveissymptomer, og ha lav terskel for høyoppløselig CT og lungefunksjonstester.
Forbruket av amiodaron for hjerterytmeforstyrrelser har økt med 42 % over 10 år, og tilnærmet hele økningen er relatert til atrieflimmer. Vi tror dette reflekterer en dreining av behandlingsmål, og advarer mot glidning i indikasjonsstillingen. Artikkelen gir en kunnskapsoppdatering om farmakologiske egenskaper, indikasjoner, bivirkninger og kontrollrutiner ved bruk av amiodaron.
Artikkelen er tidligere publisert i Hjerteforum nr 3 2021, s46-49, og den trykkes med tillatelse.