De siste årene har flere nye glukokortikoider for substitusjonsbehandling ved binyrebarksvikt blitt tilgjengelig i Norge. Mens vi i flere år bare hadde mulighet til å skrive ut kortisonacetat på blå resept, er nå hydrokortison tilgjengelig på H-resept i flere ulike former, både som vanlige tabletter og formuleringer med forlenget virketid. Dette gir oss klinikere bedre muligheter til å tilpasse behandlingen til den enkelte pasient.
Sandra Dis Steintorsdottir, overlege, Avdeling for endokrinologi, sykelig overvekt og forebyggende medisin, Oslo universitetssykehus; stipendiat, Klinisk institutt 2, Universitetet i Bergen. Eystein Sverre Husebye, professor, Klinisk institutt 2, Universitetet i Bergen; overlege, Medisinsk klinikk, Haukeland Universitetssykehus.
Sviktende produksjon av binyrebarkhormoner finnes i to endogene hovedformer, primær binyrebarksvikt som skyldes sykdom i selve binyren, og sekundær (hypofysær) binyrebarksvikt som skyldes mangel på adrenokortikotropt hormon (ACTH). Langt hyppigere er iatrogen binyrebarksvikt forårsaket av farmakologisk behandling med glukokortikoider som er en form for sekundær binyrebarksvikt. Typiske kliniske trekk ved binyrebarksvikt er utilsiktet vekttap, anoreksi, postural hypotensjon, trøtthet, muskel- og magesmerter og hyponatremi. I tillegg utvikler pasienter med primær binyrebarksvikt vanligvis hyperpigmentering av hud og en uttalt salthunger. Før kortison ble tilgjengelig på slutten av 1940-tallet, var primær binyrebarksvikt dødelig. Introduksjon av hydrokortison og senere fludrokortison (for å erstatte aldosteron) revolusjonerte behandlingen og konverterte primær binyrebarksvikt til en sykdom med god prognose. Dessverre rapporterer pasientene fortsatt om redusert livskvalitet og arbeidskapasitet, og studier viser økt dødelighet [1]. Nye metoder for tilførsel av glukokortikoider synes å kunne forbedre livskvaliteten hos noen pasienter med binyrebarksvikt, og ytterligere fremskritt innen oral og parenteral terapi vil trolig bli tilgjengelig i løpet av de neste årene.
Mens både primær og sekundær binyrebarksvikt er relativt sjeldne sykdommer med prevalenser på henholdsvis 20 og 30 per 100 000, er iatrogen binyrebarksvikt relativt hyppig [2]. Om lag 2% av befolkningen bruker glukokortikoider i en eller annen form til enhver tid. Ikke bare peroral og parenteral behandling, men også lokalbehandling kan gi permanent binyrebarksvikt med behov for substitusjonsbehandling [3].
Ved ervervet primær binyrebarksvikt er sekresjonen av kortisol og aldosteron mangelfull eller helt fraværende. Den vanligste årsaken er autoimmun destruksjon av binyrebarken som i Norge utgjør om lag 90 prosent av tilfellene. Denne formen debuterer vanligst i 20-50 års alder, men kan opptre hele livet. Debut hos barn under 2 år ses svært sjelden. Autoantistoffer mot enzymet 21-hydroksylase benyttes som diagnostisk markør og er i de aller fleste tilfellene positiv [4, 5]. Den vanligste medfødte formen er kongenitt adrenal hyperplasi (CAH) som skyldes mangel på enzymet 21-hydroksylase (CYP21A2), noe som fører til kortisol- og androsteronmangel og overskudd av binyreandrogener. De alvorligste tilfellene diagnostiseres kort tid etter fødselen. Jenter med CAH kan være født med virilisering av genitalia, mens gutter ikke har en spesiell fenotype ved fødsel. CAH inngår i nyfødtscreeningprogrammet For riktig tilnærming til substitusjonsbehandling er det viktig å skille disse formene. Mens substitusjonsbehandlingen ved primær binyrebarksvikt har som formål å erstatte bortfall av aldosteron og kortisol, vil substitusjonsbehandlingen ved CAH i tillegg ha som mål å hemme overproduksjonen av androgener.
Ved sekundær og iatrogen binyrebarksvikt skyldes kortisolmangelen manglende ACTH. Under mangelfull ACTH-stimulering vil det oppstå atrofi av de kortisolproduserende cellene i binyrebarkens midtre lag. Det indre laget som produserer binyreandrogener er også utsatt. Siden aldosteronproduksjonen i hovedsak reguleres av reninangiotensinsystemet vil ikke bortfall av ACTH-stimulering føre til atrofi av det ytre laget. Derfor behøver man ikke gi fludrokortison (aldosteron erstatning) ved disse formene for binyrebarksvikt. Samtidig bruk av veksthormonsubstitusjon, som kan være aktuelt ved hypofysær binyrebakrsvikt, kan øke kortisonbehovet.
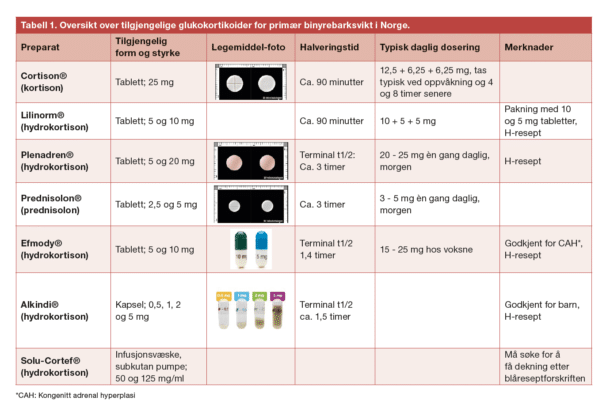
Standard substitusjonsbehandling i Norge er kortison (Cortison®) gitt i 2 eller 3 daglige doser, den høyeste ved oppvåkning og de neste, enten ved lunsj og sen ettermiddag, eller ettermiddag (2-doseregime). Ut fra beregninger av egenproduksjon vil 25 mg kortison være tilstrekkelig for de aller fleste voksne (12,5+6,25+6,25 mg), men det er inter-individuelle variasjoner og mange bruker høyere doser. Kortison som er inaktivt må omdannes til kortisol ved hjelp av 11-beta-hydroksysteroid dehydrogenase. Mange andre land benytter hydrokortison (kortisol) med anbefalt gjennomsnittlig døgndose på 20 mg. Halveringstiden for begge medikamenter er kort, om lag 90 minutter, men kortison har noe lengre virketid enn hydrokortison. Nytt i 2022 er registrering av hydrokortisontabletter i Norge under salgsnavnet Lilinorm® i en pakning med 10 mg og 5 mg tabletter, tilpasset 3-dosebehandling (10 + 5 + 5 mg daglig). Fra 1. januar 2023 er dette de eneste hydrokortisontabletter som fås på registreringsfritak (https://legemiddelverket.no/nyheter/ hydrokortison-tabletter-settes-panegativlista). Personer med sekundær binyrebarksvikt kan som oftest klare seg med mindre doser fordelt på en morgen og ettermiddagsdose, avhengig av om utfall av hypofyse-binyreaksen er komplett eller partiell. Et alternativ til multiple doser med kortison eller hydrokortison er et depotpreparat av hydrokortison, Plenadren® som tas 1 gang daglig om morgenen. Tablettens skall har lettoppløselig hydrokortison som gir en rask stigning i kortisol tilsvarende den vanlige tabletten, mens kjernen inneholder en matriks som sørger for forsinket frigjøring (Figur 1). Plenadrenbehandlingen koster om lag 30 ganger mer en Cortison og foreskrives på H-resept. Plenadren® ble godkjent for erstatningsterapi i 2011 og brukes i dag av rundt 20 prosent av pasientene med binyrebarksvikt i Norge. Godkjenningen var basert på en åpen studie som dokumenterte reduksjon av vekt, blodtrykk og glukosenivåer [6]. Oppfølgingsstudier har bekreftet at langtidsbruk av Plenadren er trygt [7], men overlegenhet i forhold til konvensjonell kortisonbehandling er ikke bevist.
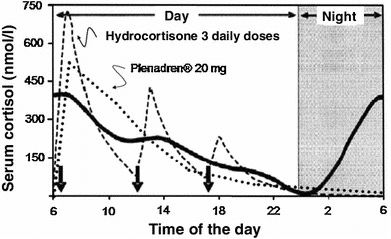
Det er derfor planlagt en nasjonal prospektiv klinisk studie med oppstart i mars 2023. Målet med studien er å undersøke om Plenadren er overlegen standardbehandling med kortison hos nydiagnostiserte pasienter med primær binyrebarksvikt (CORTAD–studien). Det primære målet er å finne ut om Plenadren gir bedre livskvalitet, arbeidsevne, søvnkvalitet og kognitiv funksjon enn standard kortisonbehandling. Sekundære mål inkluderer kliniske markører for kardiometabolske risikofaktorer, beinhelse og kortisoleksponering.
Høsten 2022 ble nok et depotpreparat med hydrokortison godkjent for bruk ved CAH, Efmody®. Denne skiller seg fra Plenadren ved at frigjøringen av medikament er forsinket («delayed release») og at den tas 2 ganger daglig. Tabletten med høyest dose tas om kvelden (typisk 15 mg) og frigjøringen starter på natten slik at høye nivåer av kortisol oppnås sent på natten og tidlig morgen. På denne etterlignes den circadiane kortisolrytmen bedre. En ny depottablett tas på morgenen (typisk 5 mg) for å forlenge kortisoltoppen og slik hemme den økte androgenproduksjonen som er et behandlingsmål ved CAH. Dette såkalte tannbørsteregimet (ved sengetid og om morgenen) har vist å kunne oppnå lavere nivåer av androgenforløperen 17OH-progesterone [8].

Dette såkalte tannbørsteregimet (ved sengetid og om morgenen) har vist å kunne oppnå lavere nivåer av androgenforløperen 17OHprogesterone [8]. Et alternativ til depottabletter med hydrokortison er å bruke Prednisolon® som har lang halveringstid. Prednisolon kan føre til økt dyslipidemi [9] og redusert benmineraltetthet [10] sammenlignet med standardbehandling med kortison. Imidlertid har en senere studie ikke gitt holdepunkter for at prednisolonbehandlingen har en ugunstig kardiometabol profil sammenlignet med hydrokortison dersom døgndosen ikke overskrider 3-4 mg daglig [11]. Prednisolon har fem ganger sterkere antiinflammatorisk effekt enn hydrokortison og den mineralkortikoide (saltretinerende) effekten er mindre enn hydrokortisonets. Deksametason er ikke indisert for erstatningsbehandling grunnet lang halveringstid og høy risiko for Cushingoide bivirkninger.
For spedbarn, barn og ungdom finnes også et spesialpreparat med hydrokortison, Alkindi®, som er granulat i kapsler med styrker fra 0,5 til 5 mg noe som gjør dosetilpasning til barn lettere [12]. Kommer man ikke i mål med tablettbehandling kan subkutan infusjon av hydrokortison i noen tilfeller være et alternativ. Hydrokortisonløsningen gis via en insulinpumpe subkutant. Med denne behandlingen kan den circadiane variasjonen i kortisol gjenskapes. Noen få studier av pumpebehandling har vist at den gir få komplikasjoner og kan bedre livskvalitet [13-16]. Vår erfaring er at den kan være til stor hjelp for enkelte pasienter. Imidlertid har det oppstått et praktisk problem i det produsenten av Solu-Cortef® har redusert holdbarheten av utblandet medikament fra 3 til 1 døgn, noe som fordrer daglig utskifting av hydrokortisonløsning i pumpen og gjør behandlingen svært kostbar. Større randomiserte studier som viser effekt av behandlingen over tid mangler.
Mineralkortikoidbehandling med fludrokortison (Florinef®) kombinert med adekvat saltinntak er indisert til alle med primær binyrebarksvikt fordi disse pasientene har mangel på aldosteron. Dette gjelder både pasienter med primær binyrebarksvikt og pasienter med salt-tapende og klassisk CAH. De fleste behøver 0,1 mg daglig (0,05- 0,15 mg) og dosering evalueres ved å spørre om salthunger og kontrollere blodtrykk sittende og stående. Plasma reninaktivitet eller reninnivå kan også benyttes, men er en grov parameter. Svært høye reninverdier, ortostatisme og hyperkalemi indikerer underdosering, mens ødemutvikling og hypokalemi tyder på overdosering.
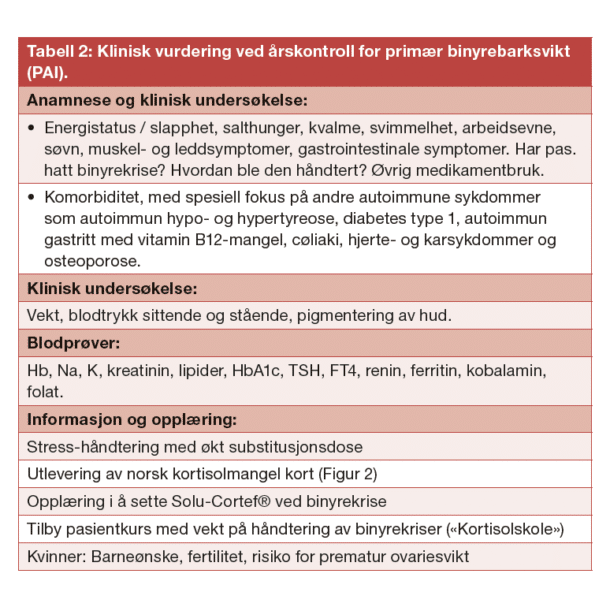
Vi anbefaler årlig kontroll av alle pasienter med binyrebarksvikt hos spesialist i endokrinologi eller indremedisin. Grunnprinsippet er å bruke lavest mulig effektiv dose kortikosteroider. Det finnes ingen god biomarkør som glukokortikoidbehandlingen kan styres etter, så det blir en klinisk vurdering av Cushingssymptomer og tegn (overdosering), vektnedgang, hypotensjon og eventuelt økende pigmentering (underdosering). Vekt, blodtrykk sittende og stående, lipidprofil og HbA1c anbefales med tanke på metabole komplikasjoner. Om man mistenker manglende opptak av medikamentet kan en kortisolkurve være nyttig med måling av serum eller spyttkortisol før og 1, 2 og 3 timer etter tablettinntak. Måling av ACTH hormon har ingen verdi ved oppfølging av behandlingen. To av tre pasienter med autoimmun primær binyrebarksvikt utvikler en annen autoimmun sykdom, vanligst autoimmun tyreoideasykdom (både Hashimotos tyreoiditt og Graves sykdom), type 1 diabetes, cøliaki, og autoimmun gastritt med vitamin B12- mangel. Årskontrollen tar sikte på å screene for disse komplikasjonene. Kvinner har økt risiko for prematur menopause, noe som opptrer hos 10-15 prosent, og er viktig å informere om. Fokus på håndtering av stress, inkludert ekstrem fysisk belastning, psykisk stress, svangerskap, operasjoner og interkurrent sykdom er viktig og alle pasienter skal utstyres med akuttkort og de fleste bør også få utskrevet Solu-Cortef® for bruk ved binyrekriser. Pasientkurs, såkalte kortisolskoler er etablert ved flere av landets sykehus der pasientene blant annet får opplæring i å sette Solu-Cortef® intramuskulært. Etter diagnose oppstår binyrekrise hos omtrent 50 % av pasientene med binyrebarksvikt og noen dør alt for tidlig av dette, så opplæring er svært viktig.
Et av de største hindrene for forskning innen binyresykdommer har vært mangel på store pasientmaterialer. Najsonalt kvalitetsregister for organspesifikke autoimmune sykdommer (ROAS) ble grunnlagt i 1996 og har etablert seg som det største i sitt slag i verden, og dekker rundt 65 prosent av norske pasienter med PAI. [4] Fra 2012 er det også et medisinsk kvalitetsregister der parametre som binyrekriser, utdeling av kortisolkort og Solu-Cortef® registreres. Mer informasjon om registeret finner du på (www.haukeland.no/roas) og på www.kvalitetsregistre.no. Vi oppmuntrer til at alle med primær binyrebarksvikt inkluderes. Det finnes også en aktiv pasientforening, Morbus Addisonforeningen som kan gi pasientene nyttig, informasjon og opplæring (www. addison.no).