Vi utførte et litteratursøk for å se nærmere på betydningen av metabolsk acidose for ulike kliniske utfall ved kronisk nyresykdom, og vi undersøkte hvorvidt det er evidens for å anbefale korreksjon av metabolsk acidose for å bedre disse utfallene. Litteratursøket tok utgangspunkt i ikke-dialysekrevende kronisk nyresykdom hos voksne pasienter, og målet var å gi klinikere en oppdatert oversikt over denne vanlige komplikasjonen til avansert kronisk nyresykdom.
Joakim Rønnestad Syrstad, medisinstudent, Universitetet i Bergen. Hans-Peter Marti, overlege og professor i nefrologi, Medisinsk klinikk, Haukeland Universitetssykehus, Bergen.
Kronisk nyresykdom har en prevalens på ca. 10% i Norge (1), og kan bli den femte største årsaken til tapte leveår i verden innen 2040 (2). Metabolsk acidose, her definert som vedvarende s-bikarbonat <22 mmol/l, er et viktig aspekt ved sykdommen, og er assosiert med økende grad av kronisk nyresykdom (3). I USA er forekomsten av metabolsk acidose estimert til 7% ved stadium 2 (eGFR 60-89 ml/min/1,73m2), 13% ved stadium 3 (eGFR 30-59 ml/min/1,73m2) og 37% ved stadium 4 (eGFR 15-29 ml/min/1,73m2) (4).
Bakgrunnen for metabolsk acidose ved kronisk nyresykdom er nyrenes sentrale rolle i vedlikehold av syre-base-homeostasen. Det vestlige kostholdet består av rikelige mengder animalsk protein, som har svovelsyre som et viktig avfallsprodukt. Dette, sammen med andre sure avfallsprodukter av metabolismen, resulterer i et daglig overskudd av ikke-volatile syrer på ca. 80 mmol (5). Nyrene kan under normale forutsetninger enkelt vedlikeholde s-bikarbonat i møte med dette overskuddet, noe de gjør ved tre mekanismer: ekskresjon av H+, reabsorpsjon av filtrert bikarbonat og nydannelse av bikarbonat.
Mekanismen med størst kvantitativt potensial for å kompensere for kronisk acidose er en tubulær prosess kalt ammoniagenese. Som vist i figur 1 forbrukes da sirkulerende glutamin for å produsere ammonium (NH4+), som surgjør urinen, og bikarbonat (HCO3–), som tas opp i blodet. En frisk nyre kan gjennom ammoniagenesen øke den daglige H+-ekskresjonen opp til ca. 500 mmol, langt mer enn de 80 mmol det daglige syreoverskuddet representerer (5).
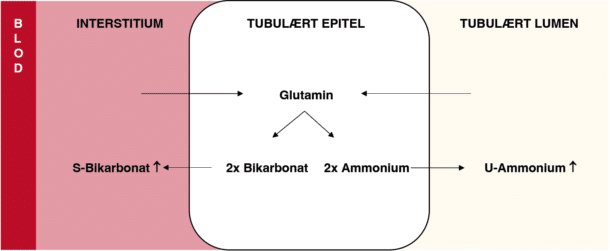
I kronisk syke nyrer tapes gradvis flere og flere funksjonelle nefroner. Langt ut i forløpet av sin sykdom kan pasientene likevel vedlikeholde normal s-bikarbonat. Dette skyldes at det i hvert resterende, funksjonelle nefron skjer en kompensatorisk økning i ammoniagenesen opp til 3-4 ganger over normalen, som holder total ammoniagenese i nyrene relativt stabil tidlig i forløpet av sykdommen (6). Med stadig mer avansert nyresykdom begynner til slutt også den totale ammoniagenesen å falle under normalen, som bidrar til å forklare at forekomsten av metabolsk acidose øker lineært med graden av nyresvikt.
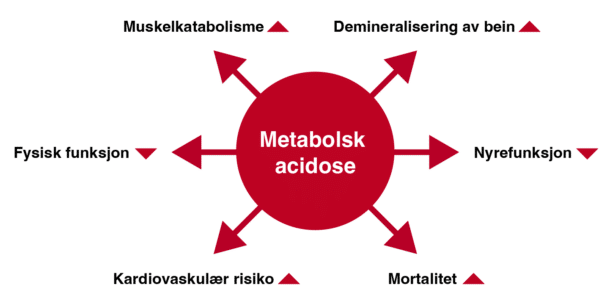
Flere observasjonelle studier har funnet signifikante assosiasjoner mellom metabolsk acidose ved kronisk nyresykdom og en rekke kliniske utfall, som illustrert i figur 2. Metabolsk acidose er assosiert med økt katabolisme av muskelproteiner, økt demineralisering av bein, økt risiko for kardiovaskulær sykdom (3), økt mortalitet uavhengig av årsak og raskere progresjon av nyresykdom (6). Det er bredt akseptert at metabolsk acidose er å regne som en risikofaktor for disse utfallene, og et sentralt spørsmål blir da hvorvidt man kan forebygge dem ved å korrigere den metabolske acidosen. Det er primært dette spørsmålet vi vil se nærmere på i denne artikkelen.
KDIGO (Kidney Disease: Improving Global Outcomes) foreslår i sine retningslinjer for kronisk nyresykdom, sist oppdatert i 2012, at man starter behandling av metabolsk acidose når s-bikarbonat vedvarende faller under 22 mmol/l (7). Behandlingsmålet er å holde s-bikarbonat innenfor normalområdet, fortrinnsvis 24-26 mmol/l (6). Dette er også i samsvar med norske anbefalinger (8).
Det finnes flere tilnærminger for korreksjon av kronisk metabolsk acidose, som sammenfattet i tabell 1. Supplementering med oral base for å øke s-bikarbonat er den vanligste tilnærmingen i norske sykehus, primært i form av natriumbikarbonattabletter (Natron). Anbefalt dosering av natriumbikarbonat er 0,5-1g x 2-4 daglig, og titreres til s-bikarbonat er i normalområdet (8). Viktige fordeler med natriumbikarbonat er at det er billig, tilgjengelig og godt tolerert blant pasientene. En vanlig bivirkning er luftplager fra fordøyelseskanalen relatert til økt CO2, men en større bekymring for klinikerne er risikoen for en natriumrelatert volumekspansjon, særlig hos pasienter med komorbid hjertesvikt. En fersk metaanalyse av Beynon-Cobb et al. (9) fant imidlertid at behandling med natriumbikarbonat ikke fører til signifikant påvirkning av systolisk blodtrykk og at behandlingen ikke er assosiert med signifikant økt dosering av hverken antihypertensiva eller diuretika. De inkluderte studiene hadde riktignok ekskludert pasienter med uttalt hjertesvikt.
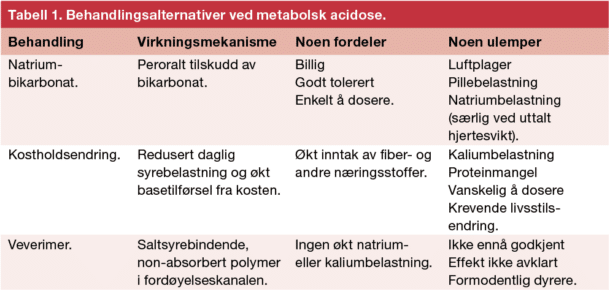
Kostholdsintervensjon kan være et godt supplement til natriumbikarbonat, og tar sikte på to ulike endringer. Den ene er å redusere den daglige syrebelastningen ved å begrense inntaket av svovelholdige aminosyrer (animalsk protein, visse kornsorter). Den andre er å øke inntaket av frukt og grønnsaker, som vil øke baseinntaket fra kosten (4).
Et nytt medikament, veverimer, er under utvikling for behandling av kronisk metabolsk acidose. Det er en oralt administrert polymer som selektivt binder saltsyre i fordøyelseskanalen, hvilket medfører en netto økning i s-bikarbonat fordi den følgelig økte sekresjonen av klor i magesekken er koblet til en samtidig produksjon av bikarbonat. Resultatene fra fase 1 og fase 2 av kliniske studier har vært lovende, hvor veverimer har vist seg som et trygt og godt tolerert medikament som signifikant øker s-bikarbonat sammenlignet med placebo (10). Resultatene fra fase 3 ventes i 2024, og vil gi et bedre evidensgrunnlag for vurdering av effekten av å korrigere metabolsk acidose hos pasienter med kronisk nyresykdom (ClinicalTrials.gov Identifier: NCT03710291).
Blant de mest spennende observasjonelle funnene for metabolsk acidose hos pasienter med kronisk nyresykdom er at det synes å være en uavhengig risikofaktor for raskere progresjon av sykdommen (6). Mekanismene som forklarer en slik nyreskadelig effekt av metabolsk acidose er ikke fullstendig kartlagte, men flere muligheter er foreslått. En sentral tanke er at den adaptive økningen i mengden ammonium produsert per nefron ved metabolsk acidose leder til en økt aktivering av komplementsystemet, økt aktivering av renin-angiotensin-aldosteronsystemet og økt renal produksjon av endothelin-1. Alle disse mekanismene kan tenkes å øke kronisk interstitiell inflammasjon og fremskynde utvikling av renal fibrose (6).
En systematisk review og metaanalyse utført av Shi et al. (11) sammenfattet 18 kontrollerte kliniske studier med median oppfølgingstid på nesten 20 mnd., og vurderte effekten av å korrigere metabolsk acidose hos pasienter med kronisk nyresykdom. Sammenlignet med kontroll-gruppen reduserte korreksjon av metabolsk acidose raten av fall i eGFR med 2,6 ml/min/1.73 m2 per år (95% konfidensintervall: 0,88-4,31). De så også på forskjellen i forekomst av nyresvikt-hendelser (definert som mer enn 50% fall i eGFR, en dobling av s-kreatinin eller progresjon til endestadiums nyresvikt), og fant at korreksjon av metabolsk acidose var assosiert med en relativ risiko på 0,45 for slike hendelser under oppfølgingstiden (95% konfidensintervall: 0,25-0,82).
En spesielt stor og viktig enkeltstudie på dette området er Use of Bicarbonate in Chronic Renal Insufficiency (UBI), en multi-senter studie fra Italia utført av Iorio et al. (12). Her inkluderte man 740 pasienter med kronisk nyresykdom, som ble randomisert til å motta enten natriumbikarbonat titrert til s-bikarbonat >24 mmol/l eller standardbehandling. Pasientene ble i snitt fulgt over 30 mnd., hvorpå man fant en dobling av s-kreatinin hos 6,6% i intervensjonsgruppen mot 17,0% i kontrollgruppen (p<0,0001). Ved slutten av studien var 6,9% i intervensjonsgruppen dialysekrevende, mot 12,3% i kontrollgruppen (p=0,005).
Til dags dato er UBI-studien den største og mest lovende enkeltstudien som antyder at korreksjon av metabolsk acidose kan være et sykdomsmodifiserende hjelpemiddel i behandlingen av pasienter med kronisk nyresykdom. Flere andre enkeltstudier har også funnet lovende resultater på dette området, men det kan være verdt å merke seg en ny studie av Mohebbi et al. (13) som ikke fant effekt av behandling på progresjonen av nyresykdom når de kun inkluderte nyretransplanterte pasienter med kronisk nyresykdom.
Som nevnt er den sentrale renale tilpasningen i møte med kronisk metabolsk acidose en økt ammoniagenese per nefron, hvor glutamin metaboliseres med bikarbonat og ammonium som resultat. For å dekke det økte glutaminforbruket økes muskelkatabolismen, hovedsakelig via en nedsatt sensitivitet for insulin-mediert suppresjon av katabolisme i muskelceller (10).
Dubey et al. (14) fulgte i en åpen, randomisert studie 188 pasienter med kronisk nyresvikt i stadium 3 og 4 over seks mnd. for å bl.a. vurdere effekten på muskelmasse og fysisk funksjon ved natriumbikarbonat titrert til serumverdi mellom 24-26 mmol/l, sammenlignet med en kontrollgruppe som mottak standardbehandling. I studien fant man signifikant bedre midtarmsomkrets i intervensjonsgruppen sammenlignet med kontrollgruppen (+0,1cm vs. -0,3cm) samt signifikant bedre gjennomsnittlig mager kroppsmasse målt med DXA (dual X-ray absorptiometry) i intervensjonsgruppen sammenlignet med kontroll (+0,3kg vs. -0,2kg).
I fase 1 og 2 av kliniske studier for det nye legemiddelet veverimer fant man at det å behandle metabolsk acidose ved kronisk nyresykdom hadde en signifikant effekt på fysisk funksjon og livskvalitet (10). Etter 52 uker var endringen i tid brukt for å fullføre standardisert sitte-til-stå-test redusert med 4,3s i veverimergruppen, mot 1,4s i placebogruppen (p<0,0001). Fysisk funksjon og livskvalitet ble også vurdert vha. et standardisert spørreskjema for pasienter med kronisk nyresykdom (KDQOL). Endringen i total poengsum var her +11,4 for veverimergruppen, mot -0,7 for placebogruppen (p<0,0001). Disse resultatene kan peke i retning av at korreksjonen av metabolsk acidose kan bidra til å bremse fallet i, og kanskje også bedre, den fysiske funksjonen til pasientene.
Andre studier har ikke lyktes med å finne tilsvarende lovende effekter. BICARB-studien var en multi-senter, randomisert, placebokontrollert og dobbelblindet studie som inkluderte 300 eldre pasienter med kronisk nyresykdom, hvor det primære utfallet av studien var forskjeller mellom gruppene i deres fysiske funksjon målt ved SPPB (Short Physical Performance Battery) (15). BICARB-studien fant ingen signifikante forskjeller i fysisk funksjon mellom gruppene etter 12 mnd, og studien er en av få som har løftet frem bekymringen om at en korreksjon av metabolsk acidose kan gjøre vondt verre for helsen til pasienter med kronisk nyresykdom. Noen viktige svakheter ved studien var imidlertid en stor andel manglende data etter 12 mnd, samt at acidosen var ufullstendig korrigert i intervensjonsgruppen.
Assosiasjonen mellom kroniske syre-base-forstyrrelser og mortalitet følger en U-formet kurve, hvor en økning i mortalitet ses både ved s-bikarbonat <22 og ved s-bikarbonat >29 (16). Blant de vanligste årsaker til mortalitet blant pasienter med kronisk nyresykdom er kardiovaskulær sykdom, og observasjonelle funn antyder at metabolsk acidose kan representere en 54% økt relativ risiko for kardiovaskulær sykdom sammenlignet med s-bikarbonat 22-26 mmol/l (3).
Flere forklaringer på økt kardiovaskulær risiko ved metabolsk acidose er foreslått. Blant annet har metabolsk acidose blitt assosiert med økt kalsifisering av karveggen. En studie fra Sør-Korea som inkluderte 2000 pasienter med kronisk nyresykdom fant at metabolsk acidose var assosiert med økt arteriell stivhet når dette ble målt ved pulsbølgehastighet (17). En annen mulig forklaring for økt kardiovaskulær risiko ved metabolsk acidose er hyperkalemi. Aktiv sekresjon av H+ til urinen i distale tubuli skjer dels i bytte mot kalium. Mer kalium enn vanlig reabsorberes altså i nyrer som kompenserer for en metabolsk acidose (5). I tillegg har intracellulært kalium en bufferfunksjon i kroppen, hvor en økning av ekstracellulær H+ fører til et skift av H+ inn i cellene i bytte mot K+. Man har dermed en økt risiko for klinisk relevant hyperkalemi og kaliumrelaterte kardiovaskulære hendelser ved metabolsk acidose (18), dette på toppen av at kronisk nyresykdom i seg selv øker risikoen for hyperkalemi grunnet redusert renal utskillelse.
Flere har også løftet frem bekymringen om at selve korreksjonen av metabolsk acidose kan øke den kardiovaskulære risiko, dette fordi man fra kjemiens verden vet at en blanding av kalsium og natriumbikarbonat fører til utfelling av kalsiumkarbonat. Påstanden om at dette øker den kardiovaskulære risikoen for mennesker har man i dag ikke god evidens for. Kendrick et al. (19) rapporterte i en pilotstudie med 18 deltakere at korreksjon av metabolsk acidose hos pasienter med kronisk nyresykdom heller førte til en mild bedring i blodstrømsmediert dilatasjon av arteria brachialis. Aigner et al. (20) benyttet i sin studie T50-testen for å analysere tilbøyeligheten for serum-kalsifisering hos 35 pasienter med kronisk nyresykdom stadium 3 og 4. En redusert T50-tid har en kjent assosiasjon til økt arteriell stivhet og økt mortalitet. Deltakerne ble behandlet med oral natriumbikarbonat, og ble randomisert til å oppnå enten s-bikarbonat 20 ± 1 mmol/l eller 24 ± 1 mmol/l. I studien fant man at forskjellen i s-bikarbonat etter behandling ikke hadde ført til signifikante forskjeller i T50-tiden når denne ble målt etter 4 ukers behandling.
Iorio et al. (12) så i UBI-studien nærmere på pasienter behandlet med natriumbikarbonat titrert til s-bikarbonat >24 mmol/l vs. standardbehandling. De fant at det etter 30 mnd. var en 57% lavere risiko for mortalitet i intervensjonsgruppen (p=0,01). I den samme studien fant de at 14,2% av pasientene som fikk natriumbikarbonat hadde vært hospitalisert i denne perioden, mot 34,6% i kontrollgruppen (p<0,001), samt at den totale varigheten på sykehusopphold per år også var kortere i natriumbikarbonatgruppen (400 dager/år vs. 1160 dager/år, p<0,001).
Den tidligere nevnte metaanalysen av Shi et al. (11) fant ingen signifikante forskjeller mellom intervensjons- og kontrollgrupper når det kom til total mortalitet. De fant heller ingen signifikant forskjell når det kom til kardiovaskulære hendelser. Resultatene hadde imidlertid store konfidensintervaller, noe som gjør det vanskelig å trekke konklusjoner fra funnene.
Negative effekter på bein og muskulatur var blant de første identifiserte komplikasjonene til metabolsk acidose ved kronisk nyresykdom, og var den viktigste årsaken til at National Kidney Foundation (NKF) tidlig på 2000-tallet begynte å foreslå behandling med oral base (3).
Beinvev spiller en sentral og ofte oversett rolle for syre-base-reguleringen i kroppen, både i akutt og kronisk fase. Ved kronisk metabolsk acidose ses inhibisjon av osteoblaster og stimulering av osteoklaster, hvilket medfører en netto demineralisering av beinvev slik at det bl.a. frigjøres buffersubstanser fra beinvevet i et forsøk på å vedlikeholde s-bikarbonat. Ved kronisk nyresykdom ser man typisk også endokrine forstyrrelser, særlig sekundær hyperparatyreoidisme, som ytterligere bidrar til nedbrytningen av beinvev hos disse pasientene (21).
De negative effektene av kronisk metabolsk acidose på beinvev er godt dokumentert i eksperimentelle studier, men man mangler evidens for at behandling forebygger demineraliseringen. Melamed et al. (22) fant i en placebo-kontrollert, randomisert studie med 149 pasienter fulgt over 24 mnd at natriumbikarbonat ikke hadde signifikant effekt sammenlignet med placebo på beintetthet målt med DXA (dual-energy X-ray absorptiometry). Studien hadde imidlertid flere svakheter, som et frafall på ca. 30% og at gjennomsnittlig s-bikarbonat hadde vært i normalområdet for begge gruppene ved studiens utgangspunkt. I en annen randomisert, dobbelblindet og placebokontrollert studie av natriumbikarbonat mot placebo fulgte man 187 eldre pasienter med kronisk nyresykdom (15). Etter ett år fant man ingen signifikant forskjell i markører for beinmetabolisme, og planer for videre beintetthetsmålinger ble avbrutt pga. svak rekruttering. Også denne studien hadde resultater hvis tolkning er vanskeliggjort av de to gruppenes s-bikarbonat, denne gang at metabolsk acidose var ufullstendig behandlet i intervensjonsgruppen. Det er følgelig få gode kliniske studier som har lyktes med å vurdere effekten av å korrigere metabolsk acidose på demineralisering av beinvev, og det er et stort behov for videre forskning på området (21).
I tråd med rådende norsk og internasjonal praksis, vil vi basert på litteratursøket fortsatt anbefale oppstart av behandling som korrigerer metabolsk acidose hos voksne pasienter med kronisk nyresykdom når s-bikarbonat er vedvarende <22 mmol/l, fortrinnsvis med peroralt natriumbikarbonat. Observasjonelle data støtter at metabolsk acidose hos en pasient med kronisk nyresykdom kan betraktes som en risikofaktor for utfall som økt katabolisme av muskelproteiner, økt demineralisering av bein, økt progresjon av nyresykdom, økt risiko for kardiovaskulær sykdom og økt mortalitet uavhengig av årsak. Vi fant relativt god evidens for at korreksjon av acidosen forsinker progresjonen av nyresykdom, og fant moderat evidens for et forsinket tap av muskelmasse og fysisk funksjon. Vi fant kun svak evidens for at behandlingen forebygger demineralisering av bein, kardiovaskulær sykdom og total mortalitet. Vi ser videre et sterkt behov for gode kliniske studier som ser nærmere på disse effektene.
Forfattere oppgir ingen interessekonflikter.
1. Hallan SI, Coresh J, Astor BC, Asberg A, Powe NR, Romundstad S, et al. International comparison of the relationship of chronic kidney disease prevalence and ESRD risk. J Am Soc Nephrol. 2006;17(8):2275-84.
2. Goraya N, Narayanan M, Wesson DE. Management of Metabolic Acidosis in Chronic Kidney Disease: Past, Present, and Future Direction. Adv Chronic Kidney Dis. 2022;29(4):416-23.
3. Melamed ML, Raphael KL. Metabolic Acidosis in CKD: A Review of Recent Findings. Kidney Med. 2021;3(2):267-77.
4. Raphael KL. Metabolic Acidosis and Subclinical Metabolic Acidosis in CKD. J Am Soc Nephrol. 2018;29(2):376-82.
5. Hall JE. Guyton and Hall Textbook of Medical Physiology. 13th ed. Philadelphia: Elsevier; 2015.
6. Kovesdy CP. Pathogenesis, consequences, and treatment of metabolic acidosis in chronic kidney disease [Internett]. UpToDate; 2021 [updated 06.04.2021; cited 2023 20. mars]. Available from: https://www.uptodate.com/contents/pathogenesis-consequences-and-treatment-of-metabolic-acidosis-in-chronic-kidney-disease.
7. KDIGO. CKD evaluation and management [Internett]. KDIGO; 2012 [cited 2023 20. mars]. Available from: https://kdigo.org/guidelines/ckd-evaluation-and-management/.
8. Legemiddelhåndboka. T13.4.3 Kronisk nyresykdom [Internett]. Norsk legemiddelhåndbok; 2021 [cited 2023 20. mars]. Available from: https://www.legemiddelhandboka.no/T13.4.3/Kronisk_nyresykdom.
9. Beynon-Cobb B, Louca P, Hoorn EJ, Menni C, Padmanabhan S. Effect of Sodium Bicarbonate on Systolic Blood Pressure in CKD: A Systematic Review and Meta-Analysis. Clin J Am Soc Nephrol. 2023;18(4):435-45.
10. Mathur VS, Li E, Wesson DE. Effects of veverimer on serum bicarbonate and physical function in diabetic patients with chronic kidney disease and metabolic acidosis: subgroup analysis from a randomized, controlled trial. Nephrol Dial Transplant. 2022;37(7):1302-9.
11. Shi H, Su X, Yan B, Li C, Wang L. Effects of oral alkali drug therapy on clinical outcomes in pre-dialysis chronic kidney disease patients: a systematic review and meta-analysis. Ren Fail. 2022;44(1):106-15.
12. Di Iorio BR, Bellasi A, Raphael KL, Santoro D, Aucella F, Garofano L, et al. Treatment of metabolic acidosis with sodium bicarbonate delays progression of chronic kidney disease: the UBI Study. J Nephrol. 2019;32(6):989-1001.
13. Mohebbi N, Ritter A, Wiegand A, Graf N, Dahdal S, Sidler D, et al. Sodium bicarbonate for kidney transplant recipients with metabolic acidosis in Switzerland: a multicentre, randomised, single-blind, placebo-controlled, phase 3 trial. Lancet. 2023;401(10376):557-67.
14. Dubey AK, Sahoo J, Vairappan B, Haridasan S, Parameswaran S, Priyamvada PS. Correction of metabolic acidosis improves muscle mass and renal function in chronic kidney disease stages 3 and 4: a randomized controlled trial. Nephrol Dial Transplant. 2020;35(1):121-9.
15. BiCARB study group. Clinical and cost-effectiveness of oral sodium bicarbonate therapy for older patients with chronic kidney disease and low-grade acidosis (BiCARB): a pragmatic randomised, double-blind, placebo-controlled trial. BMC Med. 2020;18(1):91.
16. Adeva-Andany MM, Fernández-Fernández C, Mouriño-Bayolo D, Castro-Quintela E, Domínguez-Montero A. Sodium bicarbonate therapy in patients with metabolic acidosis. ScientificWorldJournal. 2014;2014:627673.
17. Kim HJ, Kang E, Ryu H, Han M, Lee KB, Kim YS, et al. Metabolic acidosis is associated with pulse wave velocity in chronic kidney disease: Results from the KNOW-CKD Study. Sci Rep. 2019;9(1):16139.
18. Vincent-Johnson A, Scialla JJ. Importance of Metabolic Acidosis as a Health Risk in Chronic Kidney Disease. Adv Chronic Kidney Dis. 2022;29(4):329-36.
19. Kendrick J, Shah P, Andrews E, You Z, Nowak K, Pasch A, et al. Effect of Treatment of Metabolic Acidosis on Vascular Endothelial Function in Patients with CKD: A Pilot Randomized Cross-Over Study. Clin J Am Soc Nephrol. 2018;13(10):1463-70.
20. Aigner C, Cejka D, Sliber C, Fraunschiel M, Sunder-Plassmann G, Gaggl M. Oral Sodium Bicarbonate Supplementation Does Not Affect Serum Calcification Propensity in Patients with Chronic Kidney Disease and Chronic Metabolic Acidosis. Kidney Blood Press Res. 2019;44(2):188-99.
21. Bushinsky DA, Krieger NS. Effects of acid on bone. Kidney Int. 2022;101(6):1160-70.
22. Melamed ML, Horwitz EJ, Dobre MA, Abramowitz MK, Zhang L, Lo Y, et al. Effects of Sodium Bicarbonate in CKD Stages 3 and 4: A Randomized, Placebo-Controlled, Multicenter Clinical Trial. Am J Kidney Dis. 2020;75(2):225-34.