Pasienter med diabetes eller fedme har risiko for leversykdom og bør testes for leverfibrose. FIB-4-testen og elastografi av leveren er gode verktøy. Nasjonal arbeidsgruppe for livsstilsrelatert leversykdom er i ferd med å utarbeide norske anbefalinger for håndtering av denne voksende pasientgruppen.
Mette Vesterhus, overlege PhD og professor ved Medisinsk avdeling, Haraldsplass Diakonale Sykehus, Bergen og Klinisk institutt 2, Universitetet i Bergen
Håvard Midgard, overlege PhD ved gastromedisinsk avdeling, Oslo Universitetssykehus
En stor Lancet-rapport fra 2021 viser økende mortalitet på grunn av leversykdom i Europa1. Leversykdom er nå den andre viktigste årsaken til tapte arbeidsår i Europa, kun slått av iskemisk hjertesykdom1.
Denne utviklingen drives av kombinasjonen av overvekt og det høyeste inntaket av alkohol i verden. Overvekts-relatert leversykdom er blitt den ledende indikasjonen for levertransplantasjon for flere aldersgrupper i USA og forventes å bli det også i europeiske land2,3. I Norge ser vi tilsvarende trend. I tillegg viser tall fra Global Burden of Disease en dobling siste 30 år av den aldersjusterte prevalensraten for primær leverkreft på bakgrunn av overvekts-relatert leversykdom; kreftformen er nå den 3. vanligste årsaken til kreftdød på verdensbasis1. Selv om kun 0,2-0,5% av alle med overvekts-relatert leversykdom utvikler hepatocellulært karsinom, kan det utgjøre 200-500.000 personer i Europa fordi overvekts-relatert leversykdom er blitt så vanlig4.
Tidligere har non-alkoholisk fettleversykdom (NAFLD) ofte blitt oppfattet som en fredelig sykdom, og leversteatose kan ha blitt litt tilfeldig og ulikt fulgt opp. På bakgrunn av ny kunnskap, anbefaler Lancet-rapporten1 og internasjonale retningslinjer5,6 nå at vi tar i bruk aktive og virksomme tiltak for tidlig diagnostikk av de med risiko for progressiv leversykdom, slik at vi kan forebygge heller enn å måtte behandle komplikasjoner. Foreløpig er det ingen etablert medikamentell behandling for NAFLD, men mange medikamenter er under utprøving. De mest virksomme virkemidlene på befolkningsnivå, er tiltak som reduserer alkoholkonsumet og inntak av sukkerholdige drikker1. For personer som har fått påvist leversteatose, viser studier at 7-10% vektnedgang kan redusere både fett, inflammasjon og fibrose i leveren, men økt fysisk aktivitet eller kostomlegging (Middelhavsdietten er best dokumentert) har vist positive effekter også uten at så stor vektnedgang er oppnådd6. For øvrig er det viktig å optimalisere behandling av andre kardiometabolske risikofaktorer, som hypertensjon, type 2 diabetes og dyslipidemi.
I sommer publiserte en konsensusgruppe på vegne av leverforeningene fra Europa, USA og Sør-Amerika felles ny nomenklatur for det som nå overordnet heter steatotisk leversykdom7. Den nye nomenklaturen understreker sammenhengen mellom leversteatose og det metabolske syndrom. Metabolsk dysfunksjon-assosiert steatotisk leversykdom (MASLD) inkluderer krav om at minst én kardiometabolsk faktor er til stede, og erstatter det meste av det vi tidligere omtalte som non-alkoholisk fettleversykdom (NAFLD), mens den nye diagnosen metabolsk-assosiert alkoholrelatert leversykdom (MetALD) anerkjenner at høyt alkoholforbruk og metabolske årsaker kan virke synergistisk i patogenesen. En fordel med et navneskifte er at man går bort fra å bruke en eksklusjonsdiagnose og isteden fokuserer på identifikasjon av risikofaktorer. Et av målene med arbeidet var dessuten å fjerne stigmatiserende terminologi som vil kunne representere barrierer for helsehjelp på pasient-, lege-/helsearbeider- og samfunnsnivå1.
MASLD er en kompleks tilstand hvor både insulinresistens, hepatisk lipotoksisitet og lavgradig systemisk inflammasjon står sentralt. Selv om patogenesen bare er delvis forstått, er både tarmens mikrobiota og genetiske/epigenetiske faktorer også av betydning for sykdomsutviklingen.
Hele 25-30% av den voksne befolkningen i Norge og andre land har leversteatose8. Noen grupperinger, som det internasjonale LiverScreen-prosjektet, argumenterer for befolkningsscreening for å finne de med avansert leversykdom, og har nylig publisert en algoritme for beregning av risiko for dette9. Lancet-rapporten anbefaler heller målrettet «case-finding» i høyrisikogrupper, det vil si hos personer med diabetes type 2 eller fedme (BMI > 30), samt personer med langvarig, høyt alkoholforbruk.
Pasienter med diabetes type 2 har både høy prevalens av leversteatose (opp til 66%) og betydelig høyere risiko for å utvikle avansert leversykdom enn personer med leversteatose uten diabetes10,11. En nylig studie rapporterte klinisk signifikant leverfibrose hos hele 15% av pasienter med diabetes type 2 i allmennpraksis og i indremedisinsk eller endokrinologisk poliklinikk6. Steatotisk leversykdom bør derfor ses på som en komplikasjon til diabetes type 2, på linje med diabetisk nefropati, og evaluering av leverfibrose bør inngå i årskontrollene for særlig denne form for diabetes (Figur 1). Prevalensen av steatose er svært høy ved fedme (BMI >30; 75-92%). Det er gode argumenter for å avgrense «case-finding» (fibrosetesting) ved fedme til personer med en metabolsk tilleggsfaktor, som hypertensjon eller dyslipidemi, men også personer med fedme alene har høy risiko for leverfibrose12. Retningslinjer fra internasjonale foreninger for leversykdommer så vel som endokrinologi og diabetes anbefaler nå målrettet testing for leverfibrose hos pasienter med diabetes eller fedme5,6,13.
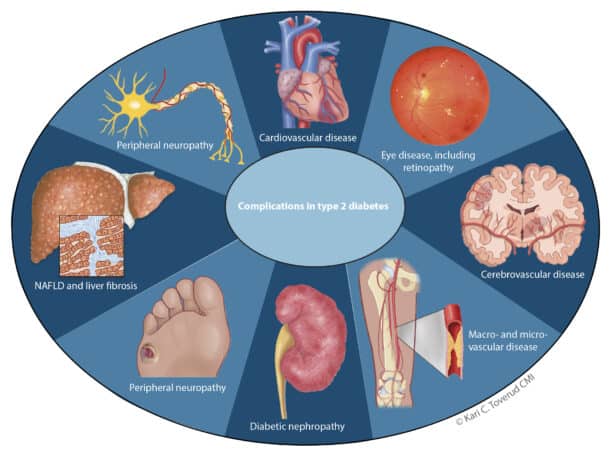
Fibrose er den klart viktigste prognostiske faktoren ved kroniske leversykdommer, mens ren steatose uten inflammasjon kan betraktes som en risikofaktor for sykdomsutvikling. Ved diabetes er leverfibrose også en uavhengig risikofaktor for kardiovaskulære hendelser og død14. Fibrosestadium bør derfor avgjøre oppfølgingsstrategi og tjenestenivå, som anbefalt i Lancet-rapporten og skissert i en norsk kronikk1,15. Tilfeldig funn av steatose med ultralyd eller annen billeddiagnostikk bør også lede til fibrosetesting. Men for pasienter i høyrisikogruppene for steatotisk leversykdom, bør fibrosetesting være den primære screeningmetoden, fordi moderat sensitivitet for mild steatose ved ultralyd kan føre til at videre utredning ikke iverksettes og leversykdom dermed overses.
Måling av transaminaser (ALAT, ASAT) har dårlig sensitivitet som screeningsmetode for fibrose og underestimerer prevalensen av både alkohol-relatert og overvekts-relatert leversykdom8,16. Mens moderat forhøyede transaminaser (<120 U/L) ses relativt hyppig ved steatose, har mange pasienter med cirrhose (opptil 91%) helt normale transaminaser17. Det er viktig å være klar over at både steatose og aktivitet i transaminaser ofte vil avta eller forsvinne etter hvert som pasienten utvikler avansert fibrose og cirrhose.
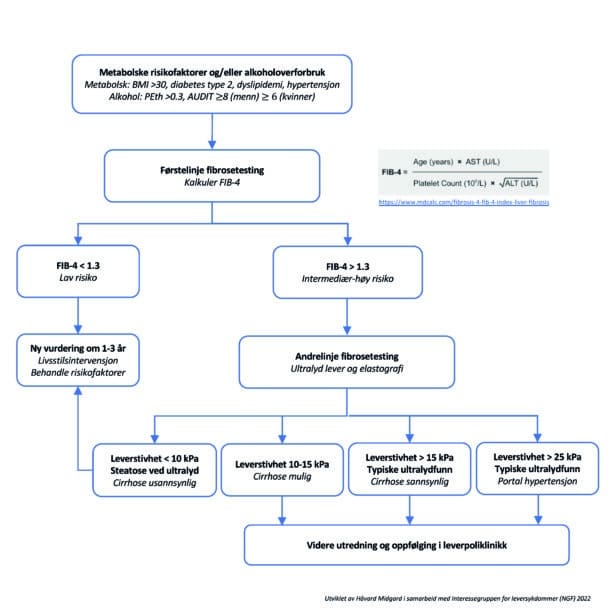
Avansert fibrose og cirrhose kan utelukkes med høy negativ prediktiv verdi med FIB-4, en enkel algoritme utregnet fra ordinær biokjemi (ASAT, ALAT, trombocytter) og alder, som utgis fra flere norske klinisk-biokjemiske laboratorier eller kan kalkuleres med nettkalkulator. Enkel tilgjengelighet og god dokumentasjon fra ulike populasjoner er fortrinn ved FIB-4 fremfor en rekke andre tilsvarende gode biomarkører, og de fleste retningslinjene går derfor inn for å anbefale denne. Brukt på riktig klinisk indikasjon (påvist steatose eller definert risikogruppe), er FIB-4 svært nyttig som første trinn i en to-stegs strategi for vurdering av leverfibrose (Figur 2). I en to-stegs strategi der den første testen har høy negativ prediktiv verdi, reduseres andelen falsk positive ved at man legger til en test nummer to. Ved FIB-4 ≥ 1,3 bør derfor fibrosestadium avklares med leverstivhetsmåling med FibroScan eller annen elastografi-modalitet, eller patenterte fibrosetester som ELF-test (når denne blir tilgjengelig ved norske sykehuslaboratorier). Studier har vist at en slik to-stegs-strategi med FIB-4 som primærtest, fulgt av elastografi eller ELF test ved FIB-4 ≥ 1,3, er kostnadseffektivt og gir redusert antall unødvendige henvisninger og redusert behov for avklarende leverbiopsi, samtidig som flere pasienter med avansert leverfibrose blir identifisert17,18. For grupper med spesielt høy risiko, som pasienter med kombinasjoner av type 2 diabetes, fedme og høyt alkoholforbruk, vil andelen falsk negative ved FIB-4 være høyere enn ellers. Det kan derfor diskuteres om elastografi eller patenterte fibrosetester bør være primærundersøkelsen for slike pasientgrupper.
På initiativ fra Norsk gastroenterologisk forenings Interessegruppe for leversykdommer, har vi sammen med representanter for foreningene for endokrinologi, allmennmedisin, rus- og avhengighetsmedisin, radiologi og klinisk biokjemi, etablert en tverrfaglig arbeidsgruppe for å utvikle nasjonale faglige anbefalinger for livsstilsrelatert leversykdom. Her vil vi utarbeide konkrete anbefalinger om steatotisk leversykdom: Klare definisjoner av hvem som skal undersøkes, med hvilke tester/undersøkelser, av hvem/på hvilket tjenestenivå, og hvor ofte. Et første utkast er under utvikling og endelig utkast vil sendes på høring i de relevante faglige foreningene før anbefalingene publiseres på Legeforeningens hjemmesider.
1. Karlsen TH, Sheron N, Zelber-Sagi S, et al. The EASL-Lancet Liver Commission: protecting the next generation of Europeans against liver disease complications and premature mortality. Lancet 2022;399:61-116.
2. Goldberg D, Ditah IC, Saeian K, et al. Changes in the Prevalence of Hepatitis C Virus Infection, Nonalcoholic Steatohepatitis, and Alcoholic Liver Disease Among Patients With Cirrhosis or Liver Failure on the Waitlist for Liver Transplantation. Gastroenterology 2017;152:1090-1099 e1.
3. Noureddin M, Vipani A, Bresee C, et al. NASH Leading Cause of Liver Transplant in Women: Updated Analysis of Indications For Liver Transplant and Ethnic and Gender Variances. Am J Gastroenterol 2018;113:1649-1659.
4. EASL. HEPAMAP, a roadmap for Hepatology Research in Europe. https://easl.eu/publication/hepamap-a-roadmap-for-hepatology-research-in-europe/ 2015.
5. European Association for the Study of the Liver. Electronic address eee, Clinical Practice Guideline P, Chair, et al. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis – 2021 update. J Hepatol 2021;75:659-689.
6. Cusi K, Isaacs S, Barb D, et al. American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings: Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocr Pract 2022;28:528-562.
7. Rinella ME, Lazarus JV, Ratziu V, et al. A multi-society Delphi consensus statement on new fatty liver disease nomenclature. J Hepatol 2023.
8. Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016;64:73-84.
9. Serra-Burriel M, Juanola A, Serra-Burriel F, et al. Development, validation, and prognostic evaluation of a risk score for long-term liver-related outcomes in the general population: a multicohort study. Lancet 2023.
10. Younossi ZM, Golabi P, de Avila L, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. J Hepatol 2019;71:793-801.
11. Tada T, Toyoda H, Sone Y, et al. Type 2 diabetes mellitus: A risk factor for progression of liver fibrosis in middle-aged patients with non-alcoholic fatty liver disease. J Gastroenterol Hepatol 2019;34:2011-2018.
12. Harris R, Card TR, Delahooke T, et al. Obesity Is the Most Common Risk Factor for Chronic Liver Disease: Results From a Risk Stratification Pathway Using Transient Elastography. Am J Gastroenterol 2019;114:1744-1752.
13. ElSayed NA, Aleppo G, Aroda VR, et al. Addendum. 4. Comprehensive Medical Evaluation and Assessment of Comorbidities: Standards of Care in Diabetes-2023. Diabetes Care 2023;46(Suppl. 1):S49-S67. Diabetes Care 2023;46:1718-1720.
14. Henson JB, Simon TG, Kaplan A, et al. Advanced fibrosis is associated with incident cardiovascular disease in patients with non-alcoholic fatty liver disease. Aliment Pharmacol Ther 2020;51:728-736.
15. Vesterhus M, Jørgensen KK, Frigstad SO, et al. [We need a new strategy for liver disease]. Tidsskr Nor Laegeforen 2022;142.
16. Lindvig KP, Hansen TL, Madsen BS, et al. Diagnostic accuracy of routine liver function tests to identify patients with significant and advanced alcohol-related liver fibrosis. Scand J Gastroenterol 2021;56:1088-1095.
17. Harman DJ, Ryder SD, James MW, et al. Direct targeting of risk factors significantly increases the detection of liver cirrhosis in primary care: a cross-sectional diagnostic study utilising transient elastography. BMJ Open 2015;5:e007516.
18. Srivastava A, Jong S, Gola A, et al. Cost-comparison analysis of FIB-4, ELF and fibroscan in community pathways for non-alcoholic fatty liver disease. BMC Gastroenterol 2019;19:122.