Nyresykdom og hjertesykdom er tett forbundet og hyppig i indremedisinsk praksis. Denne artikkelen gir oppdatert kunnskap om patofysiologi ved kardiorenal interaksjon og om utviklingen innen nefroprotektiv behandling. Artikkelen er skrevet primært til kardiologer, men ansees også viktig for indremedisinere. Indremedisineren spiller en viktig rolle i tidlig vurdering og behandling av sykdom i både nyrer og hjerte- og karsystemet.
Bård Waldum-Grevbo, Overlege PhD, Nyremedisinsk avdeling, Oslo universitetssykehus, Ullevål
Begrepet kardiorenalt syndrom har tradisjonelt vært brukt om nyresvikt sekundært til en sviktende hjertefunksjon. Et mer moderne syn på kardiorenalt syndrom er derimot å betone den patofysiologiske interaksjon mellom de to organsystemene og hvordan sykdom i det ene medfører dysfunksjon og leder til sykdomsprosesser i det andre organsystemet. Ny kunnskap har vevet kardiovaskulær sykdom og nyresykdom ytterligere sammen. Kronisk nyresykdom er utbredt i befolkningen og er en sterk kardiovaskulær risikofaktor som kan forklare en stor andel av hjerte-/karhendelser som fører til sykehusinnleggelse, sykelighet og død. Nyresykdom er samtidig en fryktet komplikasjon av hjerte-/karhendelser og kan komplisere optimal behandling av hjertemedisinske tilstander. Ved hjertesvikt har 3 av 4 grunnpilarer i den medikamentelle behandlingen en kjent virkning med stigende kreatinin etter innsetting, doseendringer og ved interkurrente hendelser. De samme medikamentgruppene er samtidig dokumentert nefroprotektive over tid, og hjertesviktpasienter med nyresykdom kan ha særlig stor nytte av medikamentgruppene.
Målet med denne artikkelen er å belyse sentrale patofysiologiske prosesser bak de kardiorenale interaksjonene, forklare prinsippene bak moderne nefroproteksjon og gi et kunnskapsgrunnlag for å tolke nyreparametre i oppfølgingen av egne pasienter. Håpet er å motivere kardiologer til å monitorere og tolke nyreparametre i oppfølgingen av pasienter i sitt eget fagfelt og stimulere til økt tverrfaglig tilnærming til en sårbar pasientgruppe.
Sykdomsprosesser i nyrer eller hjerte-/karsystemet vil uunngåelig påvirke funksjon og kunne lede til sykdomsprosesser i det andre organsystemet ved en kaskade av feedbackmekanismer. Ofte er den primære skaden vanskelig å definere da pasienten presenterer seg med kombinert skade i begge organsystemer.
Med økende alder, lang eksposisjon for felles risikofaktorer som hypertensjon, overvekt og diabetes, og økt forlenget overlevelse ved kroniske sykdommer er det forventet at prevalensen av pasienter som lever med kronisk nyresykdom og hjertesvikt vil øke de neste årene. Kunnskap om de kardiorenale sammenhengene blir derfor enda viktigere for å ivareta pasientene i tiden fremover.
Kronisk nyresykdom er en sterk, undervurdert kardiovaskulær risikofaktor. HUNT-studien forteller oss at over 10 % av Norges befolkning har kronisk nyresykdom. Pasientene diagnostiseres sent da anbefalinger for blant annet undersøkelse for albuminuri av risikoindivider ikke følges godt nok (1). Selv nyresykdom i tidlige stadier med moderat albuminuri (tidligere mikroalbuminuri) og normal glomerulær filtrasjonsrate (GFR), øker risiko for en kardiovaskulær hendelse med over 20 % og kardiovaskulær død med 40 % i forhold til estimatet fra tradisjonelle risikokalkulatorer (2). Ved høy albuminuri (albumin/kreatinin-ratio > 30) og redusert glomerulær filtrasjonsrate < 60 ml/min må man multiplisere med en faktor på 2,64 for å få et korrekt estimat for kardiovaskulær dødelighet (2).
I tidlige stadier er det aterosklerotiske kardiovaskulære hendelser som dominerer, og statiner med aggressiv LDL-kolesterol-kontroll er nå implementert i retningslinjer for behandling av kronisk nyresykdom. I sene stadier av nyresykdom er forekomst av venstre ventrikkelhypertorfi, myokardfibrose og diastolisk dysfunksjon høy, og klinikken preges av hjertesvikt og arytmier med høy dødelighet.
Med så tette patofysiologiske bånd og markert forhøyede kardiovaskulære risiko er det er betimelig å stille spørsmålet om kronisk nyresykdom bør klassifiseres som en kardiovaskulær sykdom. Ved å falle inn under kategorien sekundærprevensjon vil man øke bevisstheten om at dette er en risikopopulasjon hvor blodtrykkskontroll, LDL-kolesterol-kontroll, røykeslutt og livsstilstiltak er særlig viktig sammen med optimal medikamentell behandling.
Nyresykdom er svært utbredt i den kardiologiske populasjonen, samtidig som hovedvekten av studier som legger grunnlaget for optimal behandling av tilstandene, er gjort på pasienter uten nyresykdom. Dette gir utfordringer i vurdering av optimal behandling for hjertepasienter med samtidig nyresykdom, og historisk er det enighet om at pasientgruppen systematisk har vært rammet av en behandlingsnihilisme som har bidratt til dårlig prognose. Utviklingen de siste 10 årene har gått i riktig retning hvor retningslinjene nå er klare på at pasienter med nyresykdom i all vesentlighet skal behandles etter samme kriterier som nyrefriske pasienter. Samtidig må det erkjennes at pasientene er sårbare for komplikasjoner og bør følges ekstra tett i forløpet for å oppdage uønskede hendelser.
Pasienter med hjertesvikt har ekstra høy risiko for samtidig nyresykdom. Over halvparten av pasienter med kronisk hjertesvikt fulgt ved norske hjertesviktpoliklinikker har tegn på samtidig kronisk nyresykdom. Akutt forverring av nyrefunksjonen under innleggelse for dekompensert hjertesvikt er svært vanlig. En ond sirkel hvor sviktende nyrefunksjon forverrer stuvningssvikt med påfølgende ytterligere nyreskade er tilstanden hvor begrepet kardiorenalt syndrom historisk har vært mest brukt, selv om begrepet nå brukes i en videre kontekst.
Sykdom i nyrer eller i hjertet igangsetter en rekke komplekse feedbackmekanismer som påvirker det andre organsystemet. Hemodynamiske endringer, nevrohormonell aktivering, oksidativt stress, fibrose og inflammasjon er alle vist å ha en rolle i den kombinerte organskaden ved kardiorenalt syndrom. Kumar et al. (3) oppsummerer patofysiologien i detalj ut fra hva vi vet i dag, men i den daglige håndteringen av pasientgruppen med dagnes behandlingsalternativer kommer man langt med å fokusere på kardiorenalt syndrom som en tilstand med nevrohormonell aktivering og betydningen av væskebalanse og organstuvning.
Renin-angiotensin-aldosteron-systemet (RAAS) har en viktig rolle ved hypertensjon, progresjon av nyresykdom og kardial remodellering ved hjertesvikt. Systemet aktiveres av reninfrigjøring fra nyrene som respons på aktivering av det sympatiske nervesystem (SNS), fall i hydrostatisk trykk i afferent arteriole og redusert salttilførsel til distale deler av nefronet som tegn på redusert glomerulær filtrasjon i nefronet. Effekten av aktivering av RAAS er retensjon av salt og vann, perifer vasokonstriksjon og heving av blodtrykket. RAAS-aktivering er relatert til myocytthypertrofi, hypertensjon, organstuvning, inflammasjon, oksidativt stress og fibroseutvikling som rammer begge organsystemene. Den hemodynamiske effekten av RAAS-aktivering i nyrene er redusert nyregjennomblødning og glomerulær hypertensjon.
Økt venetrykk og organstuving har de seneste år fått økt oppmerksomhet ved kardiorenal patofysiologi. Dette er best undersøkt ved akutt dekompensert hjertesvikt, og her finner man en direkte uavhengig sammenheng mellom økt abdominalt venetrykk og GFR (3). Der tradisjonelt fokus har vært å vurdere og optimalisere kardial output for best organgjennomblødning ved akutt dekompensert hjertesvikt erkjennes nå viktigheten av lave venetrykk for renal funksjon. Ved de kroniske kardiorenale sykdomsbildene er betydningen av organstuvning mindre godt kartlagt.
Å tilstrebe euvolemi uten samtidig nevrohormonell aktivering har lenge vært et førende prinsipp ved håndtering av kardiorenale pasienter, men den kliniske vurderingen av organstuvning kan være utfordrende. Nye ultralydmetoder for objektiv undersøkelse av organstuvning kan hjelpe klinikerne til bedre å styre diuretikabehandling og indikasjon for ekstrakorporalt væsketrekk ved dialyse (4).
For å forstå hva vi mener med nefroproteksjon er det nødvendig å forstå hva vi måler og hva vi skulle ønske vi hadde mål på. Grunnlaget for å vurdere nyrefunksjonen er GFR, som i den kliniske hverdag estimeres ved bruk av formler basert på serum-kreatinin og alder. I tillegg vurderes albuminuri uavhengig av GFR.
GFR bestemmes av antall fungerende nefroner (glomeruli og tubuli i serie), renal blodgjennomstrømming og filtrasjonstrykket i den enkelte glomerulus. Ved kronisk nyresykdom reflekterer fall i GFR at det blir færre og færre fungerende nefroner. Nefrontapet kan ha mange årsaker som immunologisk destruksjon (nefritter), medfødte eller genetiske tilstander, kirurgi osv. For de aller fleste pasientene med kronisk nyresykdom er derimot glomerulær hypertensjon ansett som den mest betydningsfulle årsaken til progredierende nefrontap. Diabetes mellitus, hypertensjon og overvekt er modellsykdommene for dette prinsippet, men kompensatorisk glomerulær hypertensjon vil opptre hos alle pasienter med kronisk nyresykdom med nefrontap av betydning da organismen forsøker å holde GFR oppe på tross av redusert nefronmasse.
Ved akutte tilstander vil fall i GFR reflektere redusert filtrasjon i hvert nefron eller i en andel av nefronene som følge av ødem, inflammasjon, obstruksjon eller sirkulatoriske forhold. Potensialet for å gjenopprette normal funksjon i nefronet ved å korrigere den patologiske prosessen er tidsbestemt før nefronet erstattes av fibrose.
ACE-hemmere og angiotensin-reseptorblokkere virker vasodilaterende på den fraførende arteriolen i glomeruli. Effekten er redusert renal vaskulær motstand og senkning av filtrasjonstrykket i glomeruli. Et fall i GFR ved introduksjon av medikamentet gjenspeiler derfor en hemodynamisk endring i glomerulus og ikke nefrontap. Stigning i kreatinin på 20-30 % skal tolereres da det indikerer ønskede hemodynamiske effekter for de fleste pasientene med å redusere glomerulært filtrasjonstrykk. Ved hjertesvikt med redusert ejeksjonsfraksjon angir retningslinjene at man kan tolerere opp mot 50 % økning i kreatinin da de positive kardiale effektene over tid også vil komme nyrefunksjonen til nytte. Ved tilstander med kraftig redusert renal blodgjennomstrømming som ved dehydrering, sepsis eller bruk av NSAIDs vil bruk av ACE-hemmere eller angiotensin-reseptorblokkere kunne medvirke til at filtrasjonstrykket blir for lavt, og pasienten kan utvikle akutt nyreskade. Råd om å nulle medikamentene under akutt sykdom og å unngå bruk av NSAIDs er derfor nødvendig.
Albuminuri indikerer glomerulær eller tubulær skade. Grad av albuminuri er sensitiv for filtrasjonstrykket i glomeruli. Endring i albuminuri brukes som et surrogatendepunkt i nyremedisinsk studier da fall i albuminuri indikerer mindre nefrontap og stabilisering av GFR over tid.
Målet med moderne nefroproteksjon er å bevare flest mulig fungerende nefroner over tid (figur 1). Behandling av grunnsykdommen som ligger til grunn for nyreskaden, er grunnpilaren. Til dette gjelder behandling av immunologiske mekanismer og å fjerne nefrotoksiske ytre agens. For pasienter med hjertesykdom som årsak til nyreskaden, vil optimal behandling av hjertelidelsen være grunnlaget for å bevare nyrefunksjonen over tid da man hemmer de patofysiologiske feedback-sløyfene.
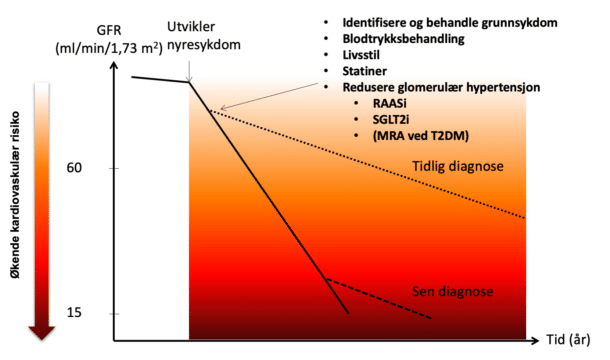
Som beskrevet er glomerulær hypertensjon et patofysiologisk prinsipp som ansees viktig for progresjon av nyresykdom hos det store antallet pasienter med kronisk nyresykdom. Her har det skjedd betydelig gjennombrudd i behandlingen de siste årene. Reduksjon av nyremedisinske endepunkter, stabilisering av GFR over tid og reduksjon av kardiovaskulære endepunkter ved bruk av SGLT2-hemmere ble først dokumentert hos pasienter med diabetes mellitus. Behandlingen er senere blitt etablert hos pasienter med hjertesvikt både med redusert og preservert ejeksjonsfraksjon uavhengig av diabetes. Sist nå foreligger store studier av pasienter med kronisk nyresykdom med dokumentert effekt på nyremedisinske endepunkter og kardiovaskulære endepunkter uavhengig av diabetes mellitus (5). Virkningsmekanismen som er best kartlagt ved SGLT2-hemming er reduksjon av glomerulær hypertensjon ved en normalisering av tubuloglomerulære feedback-mekanismer i nyrene. Medikamentene er mildt natriuretiske uten at man får uheldig nevrohormonell aktivering som man ser ved andre diuretika.
Mineralkortikoidantagonister (MRA) har lenge vært etablert behandling for hjertesvikt med redusert ejeksjonsfraksjon og et effektivt blodtrykksmedikament ved resistent hypertensjon. Ved redusert GFR har MRA vært betraktet som relativt kontraindisert på grunn av fare for hyperkalemi og forverring av nyrefunksjonen. Signaler fra subpopulasjoner i de kliniske studiene har likevel gitt holdepunkter for at MRA har nefroprotektive egenskaper over tid. Finerenon som er et ikke-steroid MRA, har vist effekter på nyremedisinske og kardiovaskulære endepunkter hos pasienter med diabetes og kronisk nyresykdom (6). Det er pågående studier og stor optimisme for at dette behandlingsprinsippet også vil vise seg holdbart hos pasienter med kronisk nyresykdom uten diabetes.
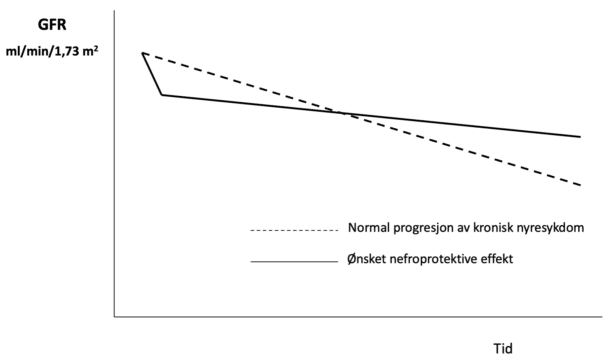
Nefroprotektiv effekt av ACE-hemmere og angiotensin-reseptorblokkere ble i sin tid først dokumentert hos pasienter med diabetes nefropati, hvoretter behandlingsprinsippet senere har vist seg gjeldende hos pasienter med kronisk nyresykdom uten diabetes. Felles for alle de tre aktuelle nefroprotektive behandlingsprinsippene med bruk av ACE-hemmer/ angiotensin-reseptorblokkere, SGLT2-hemmere og MRA er at man ved igangsetting av behandlingen vil forvente et fall i GFR med en sekundær gevinst med stabilisering av GFR over tid (figur 2). Dette kan leses som at behandlingene gir en normalisering av glomerulært trykk med sekundære nefronsparende effekter på sikt. Pleiotrope effekter utover dette er i mindre grad kartlagt, men sannsynligvis viktige tilleggseffekter som redusert fibrose og redusert oksygenbehov både i nyrer og hjerte. Diabetes nefropati må anses som en modellsykdom for et prinsipp med glomerulær hypertensjon som er utbredt ved de fleste nyresykdommer.
Hyperkalemi var tidligere en vesentlig årsak til seponering av ACE-hemmere, angiotensin-reseptorblokkere og MRA hos pasienter med kardiorenale problemstillinger. Tilgang til effektive kaliumbindere gjør at flere pasienter trygt kan behandles, og kaliumverdier under 5,5 mmol/l bør aksepteres.
Nyresykdom og hjerte-karsykdom sameksisterer i stor grad og deler en rekke felles patofysiologiske feedbacksløyfer. Fra å være en pasientgruppe som ble underbehandlet i frykt for å gjøre skade, foreligger nå evidens for at de kardiorenale pasientene har ekstra stor nytte av etablerte hjertemedisinske behandlingsprinsipper og at god hjerteproteksjon også er god nefroproteksjon. God kunnskap om hvordan man bør tolke endringer i nyremedisinske parametre som GFR og albuminuri gjennom behandlingsforløpet er essensielt for å ivareta en sårbar pasientgruppe. En stegvis opptitrering av behandlingsregimet under tett kontroll av nyreparametre og kalium er anbefalt hos pasienter med samtidig nyresykdom. Blodprøver én uke etter dosejustering av RAAS-hemmere og ved interkurrent sykdom legges til grunn for en dynamisk vurdering av risiko kontra nytte av aktuelt behandlingsregime. Økt samarbeid mellom nefrologer og kardiologer er essensielt for å møte fremtidens utfordringsbilde.
Innlegget er tidligere publisert i Hjerteforum nr 2 2023 og trykkes med tillatelse
1. Gasparini A, Evans M, Coresh J et al. Prevalence and recognition of chronic kidney disease in Stockholm healthcare. Nephrol Dial Transplant 2016; 31: 2086-94.
2. Matsushita K, Jassal SK, Sang Y et al. Incorporating kidney disease measures into cardiovascular risk prediction: Development and validation in 9 million adults from 72 datasets. EClinicalMedicine 2020; 27: 100552.
3. Kumar U, Wettersten N, Garimella PS. Cardiorenal syndrome: Pathophysiology. Cardiol Clin 2019; 37: 251-65.
4. Iida N, Seo Y, Sai S et al. Clinical implications of intrarenal hemodynamic evaluation by Doppler ultrasonography in heart failure. JACC Heart Fail 2016; 4: 674-82.
5. Nuffield Department of Population Health Renal Studies Group; SGLT2 inhibitor Meta-Analysis Cardio-Renal Trialists’ Consortium.. Impact of diabetes on the effects of sodium glucose co-transporter-2 inhibitors on kidney outcomes: collaborative meta-analysis of large placebo-controlled trials. Lancet 2022; 400: 1788-1801.
6. Agarwal R, Filippatos G, Pitt B et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J 2022; 43: 474-84.