Behandlingstilbudet med allogen stamcelletransplantasjon, der blodstamceller overføres fra menneskelig giver til pasient, har blitt utvidet de siste 30-40 år. Maligne blodsykdommer er vanligste behandlingsindikasjon. Dagens behandlingstilbud gjenspeiler økt forståelse av immuntoleranse, vevsforlikelighet, og effekten graftreaksjonen har på vertsvevet. Innlegget tar for seg virksomhetens utvikling på OUS Rikshospitalet og viktige momenter.
Tobias Gedde- Dahl d.y., seksjonsleder, overlege dr. med., Seksjon for stamcelletransplantasjon, Avdeling for blodsykdommer, Kreftklinikken, OUS, Rikshospitalet
For mange pasienter er allogen stamcelletransplantasjon (Allo-HSCT) med blodstamceller den eneste muligheten for å bli friske. På tross av at det nå er mere enn 60 år siden allogen benmargstransplantasjon ble rapportert som mulig behandling for stråleskader i form av benmargssvikt og mot leukemi, skulle det gå lang tid før metoden kunne tas i bruk som standard behandling. Haematopoietiske celler både i pasienten og i transplantatert benmarg er immunkompetente. Pasientens immunceller skal forkaste transplantatet (rejeksjon) Transplanterte donor immunceller kan analogt angripe pasientens normale vev og gi livstruende sykdom; transplantat-mot-vert-sykdom, også kjent som «Graft versus Host Disease», GvHD. De angriper også leukemiceller i pasienten, «Graft versus Leukemi effekten» (GvL). Det tar mange måneder før pasienten får immunologisk rekonstitusjon og gjenvinner normal immunfunksjon etter en allo-HSCT. Opportunistiske infeksjoner er en betydelig utfordring.
Etter atombombene mot slutten av andre verdenskrig så man at noen personer eksponert for store stråledoser overlevde, men med betydelig redusert benmargsfunksjon. Det var stort behov for å lære mer om stråleskader og behandling av slike. I 1949 viste man at mus kunne overleve stråleeksponering om man skjermet milten og at innavlede mus som var vevstypeidentiske, kunne reddes ved infusjon av benmargsceller (1).
Studier av hunder fra 1950 årene viste at massiv totalkropps bestråling ga dødlige skader i tarm og sentralnervesystemet. Hunder utsatt for lavere stråledoser døde også, men først etter et lengere forløp med blødninger og infeksjoner forårsaket av benmargssvikt. Påfølgende studier viste at disse hundene kunne reddes hvis de fikk en infusjon av benmarg fra eneggede tvillingsøsken. Hunder som ikke fikk benmarg fra tvillinger, men en annen hund (allogen benmarg) opplevde normalisering av benmargsfunksjonen primært, men døde etter et par uker i et nytt sykdomsbilde karakterisert ved kronisk diare og hudskader. Denne nye sykdommen ble kalt «the secondary disease», i dag kjent som GvHD. Da noen hunder som fikk benmarg fra en «ikke-slektning» overlevde, ble det raskt klart at man trengte bedre kunnskap om hvorfor noen hunder ikke utviklet «the secondary disease» om benmargstransplantasjon skulle bli mulig hos mennesker.
E. Donnall Thomas fikk i 1990 Nobelprisen i medisin for sitt pionerarbeid med å overføre resultatene fra tidlige transplantasjonsstudier i dyr til leukemibehandling i mennesket. Hans arbeid startet på 1950 tallet. Da viste han sammen med sine kollegaer i Seattle at en pasient med gjennombehandlet akutt leukemi fikk en remisjon på 3 måneder ved behandling med «Total Body Irradiation» (TBI) etterfulgt av infusjon av benmarg fra pasientens eneggede tvilling (2).
Bortin og medarbeidere oppsummerte i 1970 resultatene fra 200 rapporterte transplantasjoner fra perioden 1957 til 1967 som var meget realitetsorienterende. Alle 200 pasienter døde enten av «graft svikt», GvHD, infeksjoner eller tilbakefall av leukemien (3). Disse transplantasjonene var utført med liten kunnskap om forbehandling (kondisjonering), betydningen av vevstyping, matching og muligheter til å behandle GvHD. Prominente immunologer erklærte da at den immunologiske barrieren mellom individer ikke kunne krysses, og allogen stamcelletransplantasjon ble av mange ansett som et avsluttet kapittel. Mer forskning var nødvendig.
Man visste allerede i 1940-årene, ved svulsttransplantasjonsforsøk, at det var et transplantasjons-antigensystem i mus (H2-transplantasjons-antigensystemet). Om det var uforlik i H2 antigenene mellom tumor og mus, ble den transplanterte svulsten forkastet.
Ved en lang rekke eksperimenter i hunder identifiserte man et tilsvarende antigensystem på overflaten av leukocytter, såkalt Dog Leucocyte Antigen (DLA). Ved å matche DLA mellom hunder ved transplantasjon kunne man unngå eller mildne «the secondary disease». I dag kjenner vi dette hos mennesket som HLA-systemet (human leukocyte antigen), som er et helt essensielt transplantasjonsantigensystem når man matcher pasient og giver.
Senere viste man at cyklofosfamid var et alternativ/supplement til bestråling som benmargsutryddende behandling (4), og at også behandling med methotrexate etter transplantasjonen undertrykket GvHD (5).
I 1970 årene ble det rapportert kurasjon av enkelte pasienter med gjennombehandlet akutt leukemi ved å transplantere benmarg fra HLA-identiske søsken etter å ha utryddet pasientens benmarg med en kombinasjon av TBI og cyklofosfamid (6). I 1979 publiserte E. Donnall Thomas første artikkel der han beskrev en større gruppe av pasienter med refraktær leukemi som var behandlet med allogen stamcelletransplantasjon. Denne behandlingen var vellykket i halvparten av tilfellene om man transplanterte i 1. remisjon (7). Man observerte også at GvHD-reaksjonen bidro til å redusere tilbakefall av leukemien (8), hvilket antydet at donorlymfocytter kunne utrydde gjenværende leukemiceller som har overlevet kondisjoneringen.
De vanligste sykdommene man transplanterer for er maligne blodsykdommer. Eksempler er akutte leukemier eller myelodysplastiske syndromer (MDS) som har en risikoprofil som rettferdiggjør risikoen ved behandlingsmodaliteten. Ikke maligne sykdommer som alvorlig aplastisk anemi, medfødte benmargsviktsyndromer, hemoglobinopatier og enkelte medfødte immunsvikt eller metabolske sykdommer kan også være aktuelle for behandling med allo-HSCT.
Prinsippet som ligger til grunn er å erstatte en syk benmarg med en frisk. Der grunnsykdommen er malign vil intensiteten på kondisjoneringen og «graft versus leukemieffekt» (GvL) være de vesentlige komponentene i behandlingseffekten.
Utredningen inkluderer kartlegging av komorbiditet og grundig informasjon til pasient og pårørende om risikoavveiingen hos den enkelte pasient. Selve transplantasjonsforløpet starter med en kondisjonering. Denne skal gi immunsuppresjon for å hindre rejeksjon, og om grunnsykdommen er malign, også konsolidere kontrollen med grunnsykdommen (GvL).
GvHD profylakse: Ofte oppstår også GvHD ved full donor og resipient HLA-forlikelighet grunnet «minor histokompatibilitetsantigener», og det må gis GvHD profylakse for å redusere graden av GvHD etter transplantasjonen. Slike varierer noe i sammensetning bl.a avhengig av histokompatibilitet og graftkilde. En kalsineurinhemmer inngår i alle regimene og beholdes til det er oppnådd toleranse i pasienten, dvs. at pasienten basert på de transplanterte blodstamcellene evner å «lære opp» nye immunceller til å være tolerante mot sin nye vert. Ved malign grunnsykdom bør immunsuppresjonen trappes raskt ned, primært for å forsterke GvL effekten.
Etter kondisjoneringen vil det oppstå en kortere eller lengre periode med benmargsaplasi, avhengig av grunnsykdom og kondisjoneringens intensitet. Benmargsaplasien vil gi livstruende infeksjoner som krever umiddelbar behandling, og pasienten vil være avhengig av transfusjoner.
Allo-HSCT resulterer i flere helbredelser enn alternative behandlingsmodaliteter, men gir til gjengjeld mer toksisitet og mortalitet. Den opprinnelige myeloablative kondisjoneringen var så toksisk at mange pasienter ikke kunne forventes å tåle behandlingen. Pasienter med dårlig allmenntilstand, langvarig sykdom, komorbiditet og/eller komplikasjoner kunne ikke tilbys transplantasjon, rett og slett fordi behandlingen var for farlig. Etter hvert som man forstod betydningen av GvL, startet man på 1990-tallet å utvikle kondisjoneringsregimer som først og fremst var lymfoablative, dvs. forhindret rejeksjon av graftet og satset på transplantatets GvL effekt for å kurere grunnsykdommen (9). Hvis pasientene ikke utviklet GvHD, kunne man så gi eskalerte doser donorlymfocytter for å forsterke GvL effekten. Doseredusert kondisjonering har gjort allo-HSCT mindre toksisk og anvendes nå til eldre og/eller komorbide pasienter.
Utviklingen av GvHD profylaksevarianter og cellesepareringsteknikker (fjerning av T- og B-celler i graftet) har gjort det mulig å transplantere over større immunologiske ulikheter. Det er nå mulig å anvende familiedonor som kun deler en HLA-haplotype med pasienten. Dette bidrar til at vi finner anvendbare stamcelledonorer til nesten alle pasientene som er i behov av allo-HSCT.
Den første allogene stamcelletransplantasjonen i Norge ble utført i 1968 på Rikshospitalet ved professor Peter F. Hjort. En ung kvinne ble innlagt med alvorlig aplastisk anemi, hadde dårlig prognose og behandlingsmulighetene var få. Dagen etter traff professor Peter F. Hjort det han trodde var samme pasient, oppegående og tilsynelatende frisk. Dette viste seg å være pasientens eneggede tvilling. Hjort så mulighetene, og pasienten fikk overført stamceller hentet ut via innstikk i bekken- og brystben fra sin friske eneggede tvilling, og hun ble angivelig helbredet (10).
I 1980 var allogen stamcelletransplantasjon etablert behandling i de fleste vestlige land, men ikke i Norge. Pionerer fra Rikshospitalets Barneavdeling, Kirurgisk Avdeling B, Vevstypelaboratoriet, Blodbanken og Medisinsk Avdeling A etablerte tilbudet og sørget for at 23 pasienter ble transplantert fra 1981 til 1985. Resultatene var preget av at pasientene kom til transplantasjon sent i behandlingsforløpet, og det var høy dødelighet knyttet til GvHD, virusreaktivering og tilbakefall av grunnsykdommen. I 1983 ga Helsedepartementet Rikshospitalet nasjonalt ansvar for transplantasjon. Barna ble transplantert ved Barneavdelingen og de voksne pasientene i nye isolater ved Medisinsk avdeling A fra 1985 med Stein A. Evensen, Dagfinn Albrechtsen og etter hvert Lorentz Brinch som ildsjeler. Fra 1985 – 1990 ble 27 pasienter transplantert med familiedonor, resultatene sto seg godt internasjonalt. Hos pasienter som var kandidater for transplantasjon var familiegiver kun tilgjengelig hos 25%, men det var nå rapportert lovende resultater med bruk av benmarg fra godt HLA-forlikelig ubeslektet giver. Professor Erik Thorsby ved Vevstypelaboratoriet, Rikshospitalet, var internasjonalt ledende på HLA-typing. Etter en donasjon fra Kreftforeningen etablerte immunologene Erik Thorsby og Torstein Egeland, Det Norske Benmargsgiverregisteret i 1990. Dette ga tilgang på ubeslektede givere fra hele verden, og allerede samme år ble de to første norske pasientene transplantert med ubeslektet giver, begge med gode resultater (11) .
Figur 2 viser utviklingen av antall allo-HCT for voksne pasienter i Norge ved OUS siden 2005. Barneavdelingen OUS har gjort ca 25 pr år. Haukeland Universitetssykehus har gjort et lite antall allo-HSCT pr år fra 2008, fordi man etter etablering av doseredusert kondisjonering, antok at allo-HSCT skulle bli en behandlingsform ved flere maligne sykdommer basert på en antatt potensiell «graft versus tumor effekt», hvilket ikke viste seg å slå til (9).
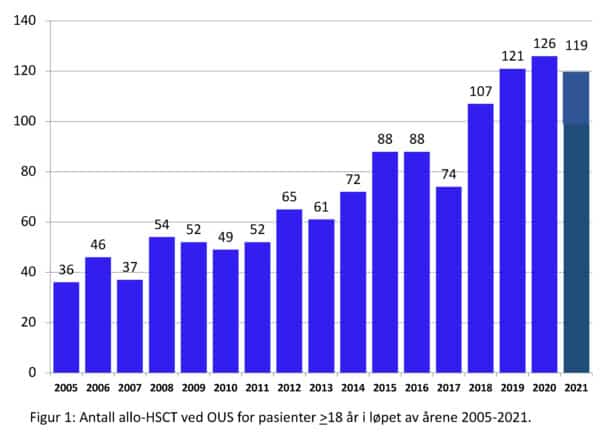
Det årlige antallet allo-HSCT i Norge var 15-20 transplantasjoner pr million innbyggere i 2012, mens det i Sverige, Finland og Danmark ble utført 20-30 pr. million innbyggere. Aktiviteter er nå på nivå med de øvrige nordiske landene. OUS Rikshospitalet dekker det estimerte behovet for allo-HSCT i landet både for voksne og barn. Seksjon for stamcelletransplantasjon ved Avdeling for blodsykdommer er akkreditert i den Europeiske organisasjonen for blod- og benmargstransplantasjon sitt kvalitetssystem. Dette muliggjør at resultatene kontinuerlig sammenlignes med resultatene fra andre europeiske transplantasjonssentra. Fordi vi har tilstrekkelig transplantasjonsvolum kan OUS raskt fange opp og korrigere trender i resultatene. Dette rettferdiggjør opprettholdelsen av en bred infrastruktur som finnes i transplantasjonssykehuset, OUS Rikshospitalet.
Samtidig som antall transplantasjoner har økt, er langtidsoverlevelsen betydelig forbedret. Andre spesialiteter vil derfor i økende grad bli involvert i utredning og oppfølging av pasienter etter allogen stamcelletransplantasjon.