Av Tom Christian Martinsen, Overlege. dr. med. Avdeling for fordøyelses- og leversykdommer, Medisinsk klinikk, St. Olavs Hospital, Universitetssykehuset i Trondheim.
Behandlingen av pasienter med inflammatorisk tarmsykdom kan være krevende. Det kommer stadig nye medisinske behandlingsalternativer for å redusere den inflammatoriske prosessen, men hovedproblemet er fortsatt at vi ikke kjenner årsaken til disse sykdommene.
Betegnelsen inflammatorisk tarmsykdom (IBD) innbefatter ulcerøs colitt (UC), Crohns sykdom (CD), og uklassifiserbar colitt hvor man ikke med sikkerhet kan skille mellom de førstnevnte. Insidensen av inflammatorisk tarmsykdom i Norge i dag er i overkant av 20/100.000 (1, 2) (dvs. ca. 1.000 nye tilfeller per år), der ulcerøs colitt er omtrent dobbelt så vanlig som Crohns sykdom. Pasientene ser ikke ut til å ha redusert levetid, og prevalensen er relativt høy (ca. 400/100.000, totalt ca. 16.000 pasienter i Norge). Mange har betydelig morbiditet og opptar mye av gastroenterologenes hverdag. Etiologien til IBD er i all hovedsak ukjent, noe som framgår tydelig av rådende hypotese hvor man antar at det enten dreier seg om en adekvat immunreaksjon mot et ikke erkjent patogen og/eller en inadekvat immunreaksjon mot et harmløst stimuli.
Dagens behandling dreier seg derfor i hovedsak om å redusere aktiv betennelse, og ikke om eliminering av de forhold som forårsaker inflammasjonen. Behandlingen er ofte langvarig, og det er risiko for bivirkninger. Det er derfor svært viktig at man, så langt det lar seg gjøre, kartlegger inflammasjon før/parallelt med oppstart av og under behandling da symptomene ofte ikke er tilstrekkelig for å bedømme grad og utbredelse av betennelse. Aktuelle undersøkelser vil først og fremst være endoskopi (gastroskopi, colonoskopi, eventuelt kapselendoskopi, ballongenteroskopi) radiologi (CT, MR, ultralyd), klinisk kjemiske prøver (Hb, CRP, trombocytter, leukocytter, albumin) og fecaltest (calprotectin).
 Valg av behandling kan være komplisert og må individualiseres ut i fra sykdomsgrad (mild, moderat og alvorlig) og utbredelse av pågående inflammasjon, tidligere sykdomsforløp, alder og eventuell komorbiditet. Vurdering av prognostiske faktorer (se tabell 1) ved valg av behandling er mest aktuelt ved Crohns sykdom og kan tilsi at man hos noen pasienter bør være spesielt våken og vurdere tidlig og potent behandling (3). Mye av debatten i senere tid har dreid seg om det er mulig å påvirke sykdomsforløpet med tidlig potent behandling (”top-down strategy”) og tett monitorering av effekt. Mange mener behandlingsmålet bør være endoskopisk eller histologisk mucosal tilheling, og ikke bare klinisk remisjon.
Valg av behandling kan være komplisert og må individualiseres ut i fra sykdomsgrad (mild, moderat og alvorlig) og utbredelse av pågående inflammasjon, tidligere sykdomsforløp, alder og eventuell komorbiditet. Vurdering av prognostiske faktorer (se tabell 1) ved valg av behandling er mest aktuelt ved Crohns sykdom og kan tilsi at man hos noen pasienter bør være spesielt våken og vurdere tidlig og potent behandling (3). Mye av debatten i senere tid har dreid seg om det er mulig å påvirke sykdomsforløpet med tidlig potent behandling (”top-down strategy”) og tett monitorering av effekt. Mange mener behandlingsmålet bør være endoskopisk eller histologisk mucosal tilheling, og ikke bare klinisk remisjon.
Vanligvis skiller vi mellom behandling av aktiv inflammasjon, hvor målet er å indusere remisjon (”induction of remission”), og vedlikeholdsbehandling av pasienter i remisjon (”maintainance of remission”).
Utprøving av flere medikamenter, både for lokal og systemisk behandling, er ofte aktuelt og kan være krevende. Det krever ofte tid å evaluere effekten, og det er viktig ”å holde stø kurs” gjennom utprøvingene, og man må så langt det lar seg gjøre sikre at adekvat dose er forsøkt over tilstrekkelig tid, slik at man ”gjør seg skikkelig ferdig med et medikament” før det eventuelt avskrives pga manglende effekt.
Ved affeksjon av venstre colon (både ved UC og CD) er det viktig å utnytte potensialet i lokalbehandling (5-ASA: stikkpiller, skum og klystervæske; steroider: klystervæske) som i perioder med fordel kan administreres flere ganger daglig. Det må understrekes at dette gjelder også ved totalcolitter hvor lokalbehandling nok er undervurdert eller ofte blir glemt.
I en utvikling med økende antall medisinske alternativer med tilhørende potensielle bivirkninger, er det grunn til å minne om at kirurgi fortsatt i en del tilfeller kan være et godt alternativ. Dette gjelder i særdeleshet ulcerøs colitt hvor kirurgi fjerner det syke organet endelig og også ved lokalisert stenoserende Crohns sykdom med fibroseutvikling, som i liten grad er tilgjengelig for antiinflammatorisk behandling.
Figur 1 viser en oversikt over de vanligste medisinske alternativer ved behandling av IBD.
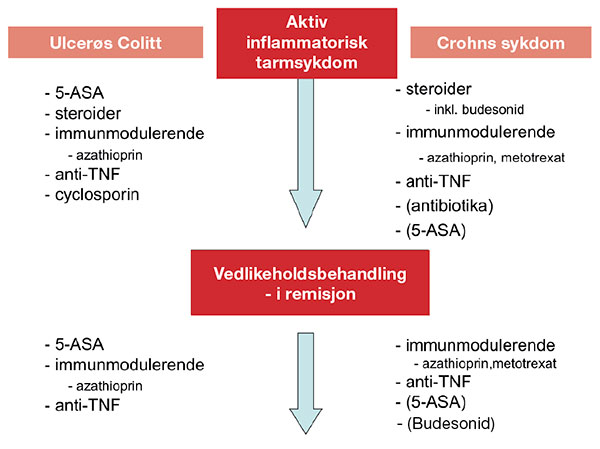
Figur 1: Oversikt over de vanligste medikamentelle alternativene ved inflammatorisk tarmsykdom (IBD) ved aktiv sykdom og ved vedlikeholdsbehandling. Preparat i parantes: usikker indikasjon. UC: ulcerøs colitt; CD: Crohns sykdom; anti-TNF: antistoffer mot tumor nekrose faktor alfa.
Effekten av systemiske steroider er godt dokumentert for behandling av alle grader av aktiv colitt, og man oppnår klinisk remisjon hos opptil 2/3 av pasientene (4). Det er særlig viktig å starte steroidbehandlingen raskt ved alvorlig colitt, da man allerede på 1950-tallet viste et mortalitetsfall fra 24% til 7% (5). Men steroider har vanligvis ingen plass i vedlikeholdsbehandling av UC.
5-aminosalicylic acid (5-ASA) er godt tolererte medikamenter som anses som basisbehandlingen av ulcerøs colitt. Også ved oral administrering gir 5-ASA lokal effekt på inflammasjonen i tarmslimhinnen. Mekanismen for effekten av 5-ASA er i stor grad ukjent. Det finnes flere typer av 5-ASA, men variasjonen består i ulike frisettingsmekanismer av samme virkestoff (5-ASA), følgelig er det ingen klare forskjeller i effekt av de ulike medikamentene på markedet. Ved behandling av aktiv ulcerøs colitt av mild til moderat grad gir 5-ASA effekt hos over 70% av pasientene og 45% oppnår remisjon (6). I de senere år er det kommet holdepunkter for økt effekt ved høyere doser (opptil 4-5 gram per døgn) (7) enn det som tidligere rutinemessig var anbefalt, og en dose per dag virker å ha minst like god effekt som flere doseringer per dag (8), trolig også på grunn av bedret compliance. 5-ASA har også godt dokumentert vedlikeholdseffekt hvor flertallet av pasientene forblir i remisjon over tid (9). Endelig reduserer denne medikamentgruppen risiko for cancer coli på sikt hos pasienter med totalcolitt.
 Ved steroidavhengig sykdom/steroidintoleranse vil behandling med immunmodulerende medikamenter som azathioprin og 6-mercaptopurin kunne være hensiktmessig. Dette er midler som er lite egnet og har relativt svak dokumentasjon ved behandling av aktiv colitt, også da det tar tid (opptil 12 uker) å oppnå effekt. Immunmodulerende medikamenter er vist å ha effekt på vedlikeholdsbehandling ved å forebygge tilbakefall samt å ha steroidsparende effekt (10, 11). Intoleranse for immunmodulerende medikamenter er ikke uvanlig og manifisterer seg gjerne i oppstartsfasen hvor pasientene må følges nøye blant annet med jevnlige blodprøver. Risiko for langtidsbivirkninger gjør at indikasjonen bør revurderes i forløpet. Metotrexat er ikke anbefalt til behandling av ulcerøs colitt.
Ved steroidavhengig sykdom/steroidintoleranse vil behandling med immunmodulerende medikamenter som azathioprin og 6-mercaptopurin kunne være hensiktmessig. Dette er midler som er lite egnet og har relativt svak dokumentasjon ved behandling av aktiv colitt, også da det tar tid (opptil 12 uker) å oppnå effekt. Immunmodulerende medikamenter er vist å ha effekt på vedlikeholdsbehandling ved å forebygge tilbakefall samt å ha steroidsparende effekt (10, 11). Intoleranse for immunmodulerende medikamenter er ikke uvanlig og manifisterer seg gjerne i oppstartsfasen hvor pasientene må følges nøye blant annet med jevnlige blodprøver. Risiko for langtidsbivirkninger gjør at indikasjonen bør revurderes i forløpet. Metotrexat er ikke anbefalt til behandling av ulcerøs colitt.
Antibiotika har ingen plass i behandlingen av ulcerøs colitt med mindre det er fare for translokasjon av mikrober ved en svært syk tarm.
I en tid med stadig nye medikamenter og behandlingsalternativer er det grunn til å minne om Truelove og Witts klassiske kriterier for identifisering av alvorlig colitt (tabell 2) (5) som stadig har vist seg å være gjeldene. Disse pasientene skal hospitaliseres, og de skal raskt gis høydose steroider parenteralt (man bør ikke vente på mikrobiologi svar), og kirurgi bør vurderes fortløpende og er spesielt aktuelt ved fravær av respons innen få døgn. I enkelte slike tilfeller vil det kunne være indisert med anti-TNF (antistoffer mot tumor nekrose faktor alfa), eventuelt cyclosporin som akuttbehandling, men resultatene på kort sikt og hva gjelder tarmbevarende effekt på lengre sikt har så langt vært usikre.
Figur 2 gir en oversikt over aktuell behandling av aktiv ulcerøs colitt ut i fra utbredelse og aktivitet.

Figur 2: Oversikt over aktuell behandling av aktiv ulcerøs colitt etter utbredelse og sykdomsaktivitet. Preparat i parantes: usikker indikasjon. AZA: azathioprin; anti-TNF: antistoffer mot tumor nekrose faktor alfa.
Systemiske steroider er godt dokumenter ved behandling av aktiv sykdom hvor opptil 80% går i remisjon sammenliknet med cirka 35% ved placebo (12). Budesonide har vesentlig mindre bivirkninger enn tradisjonelle steroider på grunn av ”first pass” metabolisme i leveren, og har vist effekt ved mild grad av ileo-cøkal sykdom (3). Heller ikke ved Crohns sykdom har man kunnet vise effekt av steroider ved vedlikeholdsbehandling, likevel blir budesonide brukt en del ved langtidsbehandling.
Effekten av 5-ASA ved Crohn colitt er fortsatt omstridt, noe som reflekteres av at 5-ASA ikke er anbefalt i European Crohn’s and Colitis Organisation (ECCO) guidelines (3) i motsetning til britiske og amerikanske retningslinjer, hvor de fremdeles er anbefalt. Uansett virker effekten å være marginal, men mange velger å forsøke behandling da de har lite/få alvorlige bivirkninger. Effekten av immunmodulerende medikamenter er bedre studert ved Mb Crohn enn ved UC, og hovedtyngden av dokumentasjonen som foreligger gjelder bruk av azathioprin/6-mercaptopurin, og i noe mindre grad metotrexat. Det foreligger relativt godt dokumentert effekt av azathioprin ved aktiv Crohns sykdom, der en metaanalyse av 8 randomiserte kontrollerte studier viste remisjon hos 54% versus 33% i placebogruppen med number needed to treat (NNT) på 5; tilsvarende tall ved vedlikeholdsbehandling var 71% versus 55% og NNT 6 (13). Effekten av metotrexat er generelt noe svakere.
Antibiotika er mye brukt ved Crohns sykdom til tross for svak dokumentasjon. Det synes å være dokumentert noe effekt for metronidazole og ciprofloxacin, men i ECCO guidelines anbefales antibiotika kun brukt ved septiske komplikasjoner (3). Antibiotika kan også være indisert ved bakteriell overvekts. Endelig nevnes at gallesyrebinder kan være indisert hos pasienter som opplever gallesyre indusert diare etter ileo-cøkal reseksjon på grunn av Crohns sykdom.
Figur 3 gir en oversikt over aktuell behandling av aktiv luminal Morbus crohn ut i fra utbredelse og aktivitet.
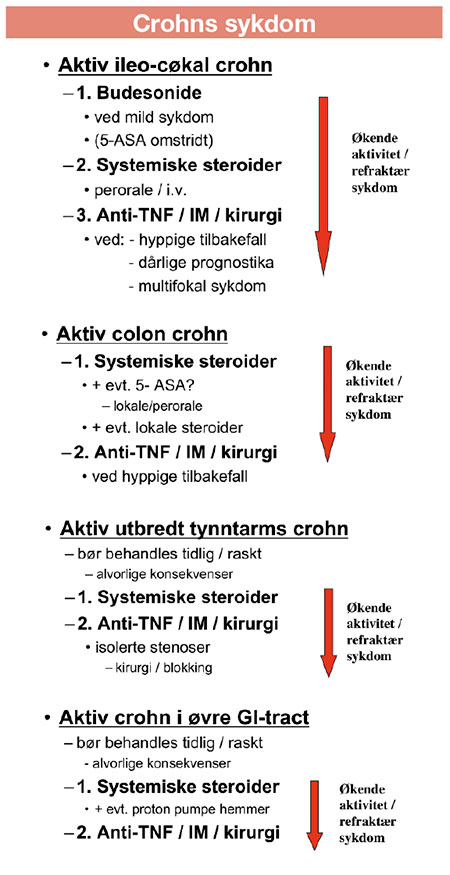
Figur 3: Oversikt over aktuell behandling av aktiv luminal Crohns sykdom etter utbredelse og sykdomsaktivitet. IM: immunmodulerende medikamenter (azathioprin / 6-mercaptopurin / metotrexat); anti-TNF: antistoffer mot tumor nekrose faktor alfa.
Medisinsk behandling av fistulerende sykdom er generelt dårlig dokumentert og i stor grad konsensusbasert. Et generelt prinsipp er å redusere inflammasjon i fistlenes tilgrensende slimhinne. Det forligger noe dokumentasjon på effekt av antibiotika som mitronidazol samt ciprofloxacin. Videre viser metaanalyser effekt av azathioprin med respons hos cirka 50% sammenliknet med rundt 25% ved placebobehandling (14).
Tumor nekrose faktor-α (TNF-α) er et viktig proinflammatorisk cytokin ved inflammatorisk tarmsykdom (IBD). Ved såkalt biologisk behandling benyttes antistoffer som binder seg til og dermed nøytraliserer TNF-α (anti-TNF), og dette er vist å ha effekt ved en rekke inflammatoriske tilstander. Infliximab (Remicade) og adalimumab (Humira) er foreløpig de to registrerte medikamentene på det norske markedet som er godkjent for behandling av både Mb. Crohn og ulcerøs colitt. Anti-TNF-behandling anses indisert ved moderat eller alvorlig inflammatorisk tarmsykdom der adekvat medisinsk behandling med 5-ASA, steroider og/eller
immunmodulerende behandling har gitt utilstrekkelig effekt eller alvorlige bivirkninger, og der kirurgi heller ikke synes hensiktsmessig (15). Effekten av anti-TNF varierer noe i de ulike kontrollerte studiene, men som en tommelfingerregel kan man hevde at initial respons finnes hos i overkant av 2/3 av IBD-pasientene, og at 1/3 går i remisjon (16). Imidlertid taper mange pasienter effekt over tid (16). Dokumentasjonen og effekten synes å være noe bedre ved Mb Crohn enn ved ulcerøs colitt.
I randomiserte kontrollerte studier beskrives det bivirkningsrater som ved placebo, men observasjonsstudier fra vanlig klinisk praksis har etter hvert vist økt risiko for blant annet alvorlige infeksjoner, hudreaksjoner og infusjonsreaksjoner (16).
I tillegg hersker en viss uro hva gjelder risiko for potensielle langtidsbivirkninger, ikke minst hepatosplenisk T-celle lymfom som er observert hos noen titalls yngre menn på verdensbasis som har brukt kombinasjon av anti-TNF og azathioprin. I en observasjonsstudie fra St. Olavs Hospital hvor man studerte 83 Crohn pasienter som hadde fått minst en dose anti-TNF i løpet av en tiårs periode fant man at ¼ av pasientene seponerte behandlingen på grunn av uteblivelse eller tap av effekt, mens ¼ seponerte på grunn av bivirkninger (17). To av fire dødsfall observert i løpet av studieperioden var vurdert å være relatert til bruk av anti-TNF.