Av Hanne Skjeldam, PhD, Medisinsk vitenskapelig rådgiver, Novartis Onkologi
Polycytemia vera er en malign klonal stamcellesykdom som drives av en overaktiv JAK-STAT signalvei. Ruxolitinib har effekt uavhengig av mutasjon og er et viktig tilskudd for PV pasienter som er resistente eller intolerante til hydroksyurea, både for å normalisere blodverdier, samt redusere plagsomme symptomer.
Polycytemia vera (PV), essensiell trombocytose (ET), myelofibrose (MF) er klassifisert som myeloproliferative neoplasier (MPN)[1]. De er alle maligne, klonale stamcellesykdommer med en rekke overlappende kliniske trekk. Generelt for alle tre, men især for ET og PV, er økt risiko for arterielle og venøse tromboser, som er den dominerende årsak til morbiditet for denne sykdomsgruppen [2]. PV er karakterisert ved forhøyede nivåer av røde blodceller, ofte i kombinasjon med høye verdier av hvite blodceller og plater [3]. Omtrent alle PV pasienter har mutasjon i Janus-kinase (JAK) som gir en overproliferasjon av blodceller [4]. Ruxolitinib (RUX) er en JAK1 og JAK2 inhibitor, som har effekt uavhengig JAK-mutasjon [5], reduserer overproduksjon av blodceller, gir kontroll over hematokrit, samt reduksjon av miltvolum og sykdomsrelaterte symptomer [6-8].
Normale hematopoietiske celler aktiveres ved at for eksempel erytropoietin bindes til reseptor. Dette gir en konformasjonsendring, fosforylering, aktivering av STAT og påfølgende celleproduksjon [9]. Hos MPN-pasienter er denne JAK-STAT signaleringen overaktiv. Oppdagelsen av mutasjoner i genet for JAK2 var det avgjørende gjennombruddet og ble banebrytende i forhold til forståelsen av kliniske trekk for MPN [10] – det gav forhåpninger om målrettet behandling. Da kun 65 % av pasienter med MF er JAK-muterte [4] var det fortsatt usikkerhet for hvorfor denne signalveien var overaktiv hos JAK-negative MPN-pasienter. Med funnet av mutasjonen i calreticulin (CALR) falt en stor brikke på plass [11], og man har nå flere mutasjoner som kan bidra til å forenkle diagnostikken av MPN-pasienter. CALR er relativt sjelden hos PV pasienter [12].
PV er den mest vanlige formen av MPN [13]. Det er viktig å nevne at selv om PV anses for å være lite aggressiv, er PV klassifisert som blodkreft [14,15]. Den uregulerte økning i antallet blodceller, med høy hemoglobin, leukocytose og trombocytose medfører økt frekvens av trombotiske hendelser. Sykdommen utvikles gradvis gjennom ulike faser, hvor sykdommen kan utvikle seg til MF samt transformere til akutt myelogen leukemi [16]. I tillegg til å føre til en uhemmet deling av blodceller, fører også denne overaktive signalveien til en voldsom økning av inflammatoriske cytokiner som kan forklare symptomer som kløe, smerter, utmattelse og nattesvette. Dette er symptomer som RUX har vist å ha god effekt på [8].
Den uregulerte økning i antallet blodceller, med høy hemoglobin, leukocytose og trombocytose medfører økt frekvens av trombotiske hendelser. Sykdommen utvikles gradvis gjennom ulike faser, hvor sykdommen kan utvikle seg til MF samt transformasjon til akutt myelogen leukemip. I tillegg til å føre til en uhemmet celledeling av blodceller, fører også denne overaktive signalveien til en voldsom økning av inflammatoriske cytokiner som kan forklare symptomer som kløe, smerter, utmattelse og nattesvette. Dette er symptomer som RUX har vist å ha god effekt på.
Generell konsensus innen behandling av PV er å unngå kardiovaskulære komplikasjoner samtidig som man ønsker å unngå å øke risikoen for hematologisk transformasjon. Griesshammer, Gieslinger og Mesa presenterte nylig en algoritme for behandling av PV, se figur 1 [17]. PV pasienter antas å ha en median overlevelse på 14.1 år, hvor pasienter som defineres som høyrisiko har en betydelig redusert median overlevelse [16]. Mange pasienter responderer godt på tradisjonell behandling, blodtapping og hydroksyurea (HU), men det er behov for alternativer for pasienter som ikke tolererer eller som utvikler resistens mot standardbehandling. Dette er tydelig illustrert ved at HU-resistente pasienter har en median overlevelse på 1.2 år [18]. I tillegg er det mange pasienter som har god kontroll på blodverdier, men som opplever at symptomene forringer deres livskvalitet. Pasientdagboken MPN-10 vil være et nyttig verktøy for å kartlegge symptombyrden, samt bedre kommunikasjon mellom lege og pasient. Symptomdagboken ble nylig godkjent av Legemiddelverket og er tilgjengelig på hematologisk avdeling på sykehus, eller på Blodkreftforeningen.no [19] for nedlasting.
Et viktig mål ved behandling av PV er å holde hematokrit nivå under 45 % da studier har vist at dette fører til færre kardiovaskulære dødsfall og alvorlige trombotiske hendelser [20]. HU er ofte brukt som cytoreduserende behandling for PV pasienter hvor blodtapping ikke er tilstrekkelig [4]. Den raske utviklingen av målrettet behandling gjorde at European Leukemia Net (ELN) og International Working Group-Myeloproliferative Neoplasms Research and Treatment utviklet standardiserte kriterier for behandlingsrespons, samt utarbeidet et forslag for definisjon av HU resistens og intoleranse, Tabell 1 [17,18].
Enkelte studier med begrenset observasjonstid (< 10 år) viser at HU ikke øker risiko for leukemisk transformasjon, mens 15-20 års oppfølgning har vist en akkumulert risiko for leukemisk transformasjon på opp til 24 % [21]. I Norge tar man hensyn til den potensielle leukomogene effekten av HU [22], noe som gjør at man har begrenset med alternativer for pasienter under 60 år.
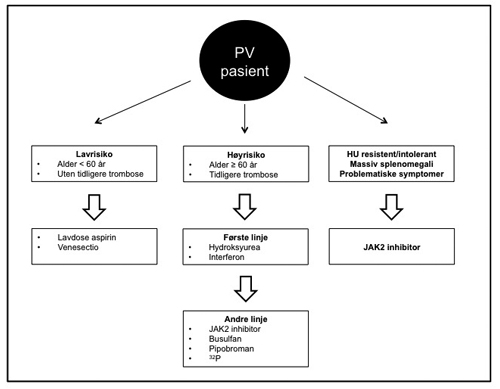
Figur 1. Algoritme for behandling av polycytemia vera [17].

RUX er en peroral og selektiv JAK1 og JAK2 inhibitor som hemmer kinaser som medierer signaleringen av en rekke cytokiner og vekstfaktorer, viktige for hematopoiese og immunfunksjon [23]. RUX er godkjent som 1. linje behandling av symptomatisk MF og nylig også for PV pasienter som er resistente eller intolerante for HU, og tilgjengelig på individuell refusjon [23]. For MF har RUX blitt sammenlignet med placebo og beste tilgjengelige behandling, demonstrert overbevisende effekt for sykdomsrelaterte symptomer, splenomegali og forbedret overlevelse [6,7]. For PV pasienter viser resultater fra en fase 2 studie at RUX var godt tolerert og oppnådde en rask og varig klinisk respons [24]. I henhold til responskriterier fra ELN oppnådde 97 % av pasientene god respons etter 24 uker med behandling. RUX forbedret symptomer som kløe, nattesvette og skjelettsmerter allerede 4 uker etter behandlingsstart. Med tanke på virkningsmekanismen til RUX var det ikke overraskende at anemi og trombocytopeni (primært grad 1) var de mest vanlige bivirkningene. En nylig publisert fase 3 studie sammenligner effekt og bivirkninger av RUX og beste tilgjengelig behandling (BAT) hos pasienter med PV, som er resistente eller intolerante til HU etter modifiserte ELN kriterier [8]. Primært endepunkt, var sammensatt av andel pasienter som oppnådde både kontroll av hematokrit kontroll og mer enn 35 % reduksjon i miltvolum etter 32 uker. 21 % mot 1 % i henholdsvis RUX og BAT armen oppnådde primært endepunkt (P<0.0001). RUX gav også betydelige forbedringer på symptomer, vurdert fra pasientbasert spørreskjema.
Disse studiene gir informasjon om effekt og nytteverdi av RUX. RUX har effekt uavhengig av mutasjon og er et viktig tilskudd for PV pasienter som er resistente eller intolerante til HU, både for å normalisere blodverdier, samt å redusere plagsomme MPN-relaterte symptomer.
Referanser