Lydia CT Buer, LiS, Gastromedisinsk avdeling, OUS
Bjørn A Moum, overlege og professor, gastromedisinsk avd, OUS og UIO
Inflammatoriske tarmsykdommer rammer ofte unge mennesker og forekomsten i vestlige land er tydelig økende. Tidlig diagnose og identifisering av risikofaktorer for alvorlig sykdom er viktig for å kunne gi tilpasset behandling.
Inflammatorisk tarmsykdom (IBD) er en samlebetegnelse på kroniske betennelsessykdommer som rammer tarmkanalen. Betegnelsen omfatter Crohns sykdom (CD), ulcerøs kolitt (UC), og uklassifiserbar IBD-kolitt (1). De fleste IBD-pasientene er unge ved diagnosetidspunktet (15-25 år for CD og 25-35 år for UC) og kommer til å leve med sin kroniske sykdom gjennom et langt liv. Sykdomsforløpet er svært varierende; fra milde og sjeldne forverringer til utbredt og alvorlig tarmbetennelse som krever gjentatte, kirurgiske inngrep. Sykdommen er i stor grad uforutsigbar, hvorfor det er viktig å tilpasse behandling og oppfølging individuelt.
IBD forekommer med store geografiske variasjoner i insidens og prevalens. Høyest prevalens er beskrevet i Nordvest-Europa (2) og i Nord-Amerika (3, 4). Norske tall viser en årlig insidens på 5,8/100.000 for CD (5) og 13,6/100.000 for UC (6). De siste tiårene har man sett en økende forekomst av IBD, sterkest i vestlige land (7). I Norge har prevalensen for CD økt med 110 % mellom 1999 og 2014, dette tilsvarte i 2014 en prevalens på 185/100.000. For UC er økningen på 80 %, noe som i 2014 tilsvarte en prevalens på 250/100.000(8).
Patogenesen bak IBD er ikke kjent, men den ledende hypotesen er at det oppstår en feilaktig immunrespons mot tarmens mikrobiota i genetisk predisponerte individer. Den raskt økende forekomsten av IBD i vestlige land indikerer at miljøfaktorer kan spille en viktig rolle. Røyking er en av de mest konsistent rapporterte risikofaktorene for CD, samtidig som det beskytter mot UC (9).
CD kan ramme hele tarmkanalen, fra munnhule til endetarmsåpning. Typisk er transmural betennelse, granulomer og fisteldannelse. Ved UC er betennelsen i prinsippet lokalisert til tykktarm og begrenset til mucosa og submucosa. Diagnosen baseres derfor på en kombinasjon av kliniske symptomer, endoskopiske funn og bildediagnostikk. MR er ofte nyttig i kartlegging av CD da dette kan avdekke sykdom i tynntarm, samt fremstille fistler eller abscesser (både intraabdominalt og perianalt). For både CD og UC kan tarmbetennelsen gi symptomer som diaré med blod og slim, magesmerter og plutselig avføringstrang. Ved mer alvorlig sykdom sees ofte allmennsymptomer som feber, vekttap og utmattelse. Pasienter med CD kan også ha plager fra fistler og strikturer. IBD kan ledsages av såkalte ekstraintestinale manifestasjoner som kan ramme ledd (artritter og artralgier), hud (erytema nodosum, pyoderma gangrenosum), øye (iridocyklitt, uveitt), eller lever.
UC og CD kan inndeles i undergrupper basert på alder ved diagnose, lokalisering, utbredelse, alvorlighetsgrad og eventuell tilstedeværelse av fistler. Montrealklassifikasjonen brukes i klinisk praksis (tabell 1-3)(10). For eksempel vil en pasient som debuterte med Crohns sykdom i terminale ileum i en alder av 20 år, og som har fått påvist trange partier i tynntarm, klassifisere som A2, L1, B2. Ved diagnosetidspunktet har omtrent 40 % av alle med CD sykdom i kolon alene, 30 % har affeksjon av både tynn- og tykktarm, og 30 % har kun sykdom i tynntarm. Utbredelsen er som regel stabil over tid. For UC er utbredelsen tilnærmet tredelt ved diagnose: distal kolitt (kun sykdom i rektum), venstresidig kolitt (sykdom begrenset til rektum og kolon distalt for venstre fleksur) og totalkolitt (sykdom som strekker seg proksimalt for venstre fleksur). Ulikt fra CD progredierer utbredelsen i tarmen gjerne over tid ved UC (11). Omlag 17 %
av alle med IBD opplever ekstra-intestinale manifestasjoner ila de første 10 årene med sykdom, dobbelt så ofte hos pasienter med CD som med UC (12). Til tross for klart økt morbiditet i gruppen er det ikke vist økt dødelighet eller økt forekomst av kreft for pasienter med IBD (13, 14).
Tidlig behov for steroider, høy CRP eller SR ved diagnose, sykdomsdebut i ung alder og utbredelse er viktige faktorer som kan peke mot et alvorlig sykdomsforløp (15-17). Det er viktig med god sykdoms-kontroll, for eksempel med biologisk behandling tidlig i sykdomsforløpet, som er mer avgjørende for langtidsprognose. Man ser en tendens til mindre sykehusinnleggelser og lavere kolektomifrekvens og trolig kan dette ha sammenheng med økende bruk av immunsuppressiv behandling og biologisk behandling(18).
Mange av de samme prinsippene gjelder for både nyoppdaget IBD som ved oppfølging av pasienter med stabil eller ustabil sykdom. Ved diagnosetidspunktet er det viktig å karakterisere sykdommens utbredelse og alvorlighetsgrad ved endoskopiske undersøkelser og eventuelt bildediagnostikk (fortrinnsvis MR) av affiserte områder. Dette bør gjentas ved alvorlige forverringer, hvor det er mistanke om progresjon av sykdom, eller for å vurdere effekt av behandling. Blodprøver (spesielt viktig er Hb, CRP, lever-/galleprøver) og fekaltest bør tas jevnlig og kan bistå i å monitorere sykdomsaktiviteten. Tabell 4 illustrerer viktige momenter ved IBD-konsultasjonen.
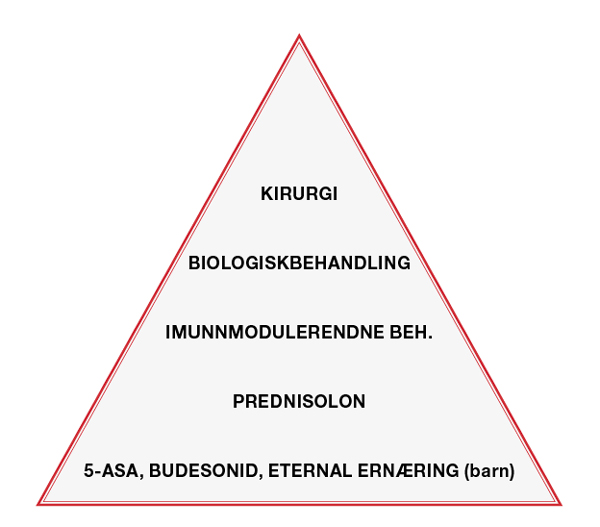
Figur 1. Behandlingspyramide for ulcerøs kolitt og Crohns sykdom. Sykdommens alvorlighetsgrad avgjør behandlingsnivå. 5-aminosalisylsyre (5-ASA) = po eller lokal behandling (stikkpiller). Immunmodulerende behandling = azatioprin og metotreksat. Biologisk behandling = infliksimab, adalimumab, golimumab, vedolizumab.
Behandlingen av pasienter med IBD avhenger av flere faktorer. Klassifikasjon i henhold til Montrealkriteriene er viktig da den forteller noe om alvorlighetsgrad og utbredelse. Videre er pasientens symptombelastning viktig. Dette må understøttes av objektive parametre som CRP, hvite, leukocytmåling, temperatur, fekaltest, endoskopi og radiologi. Dette forteller om risiko for å utvikle alvorlig sykdom i det videre forløpet. Hos pasienter med alvorlig sykdom ved diagnose, eller høy risiko for å utvikle alvorlig sykdom, vil det være naturlig å starte høyere oppe i behandlingspyramiden (Figur 1).
Man skiller mellom induksjonsbehandling, hvor målet er å dempe pågående inflammasjon, og vedlikeholdsbehandling av pasienter for å hindre tilbakefall.
Pasienter med mild til moderat UC behandles med 5-Aminosalisylsyre(5-ASA). Dette brukes både som induksjons -og vedlikeholdsbehandling. 5-ASA er den terapeutisk aktive substansen mot inflammasjon i alle disse midlene og omfatter virkestoffene mesalazin, balsalazid, olsalazin, sulfasalazin. Disse kan administreres peroralt eller rektalt (stikkpille og klystér) og har hovedsakelig virkning på kolonslimhinnen. Ved distal kolitt kan lokale midler være tilstrekkelige, alternativt i kombinasjon med systemisk behandling. Døgndosen kan med fordel gis på én gang. Virkningen på CD er høyst usikker.
Budesonid brukes ved mild til moderat aktiv kolitt. Det er et glukokortikoid med lite systemiske bivirkninger. Middelet kan administreres peroralt (Entocort®, Cortiment®, Budenofalk®) eller rektalt som (Entocort®).
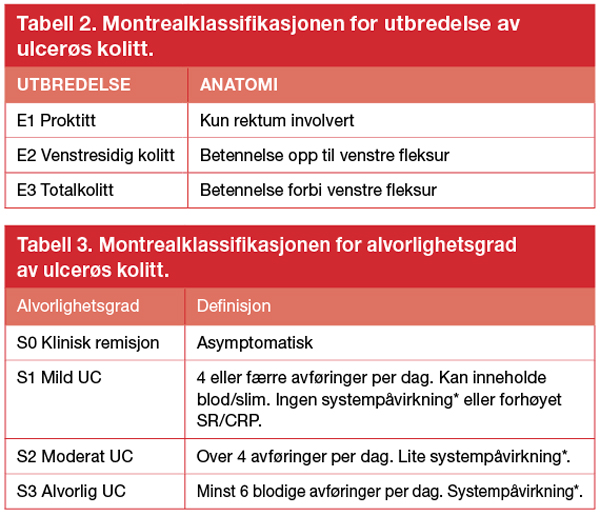
*Systempåvirkning: anemi (Hb < 10.5), takykardi (puls > 90), febrilia (temp > 37.5 °C) og SR eller CRP over 30.
Hos UC- og CD-pasienter med moderat til alvorlig aktiv tarmbetennelse vil ofte perorale steroider være nødvendig for å oppnå sykdomskontroll (19). Ved alvorlig sykdom og allment medtatt pasient er innleggelse med intravenøs behandling nødvendig. På grunn av bivirkningene av glukokortikoider er det et mål at pasienter med IBD skal bruke minst mulig av disse.
Hos pasienter med aktiv tarmbetennelse til tross for behandling med systemiske steroider, eller der inflammasjonen blusser opp så fort steroiddosen reduseres, vil det være naturlig å introdusere immunmodulerende eller biologisk behandling. Immunmodulerende midler er i denne sammenheng azatioprin eller metotreksat. De brukes hovedsakelig for å opprettholde remisjon og kan være «steroidbesparende», det vil si redusere eller helt unngå behovet for steroider hos pasienten (19). Azatioprin er et cytostatikum, en anti-metabolitt, som har antiinflammatorisk effekt. Bivirkninger (pankreatitt, beinmargspåvirkning, leverutfall), som nødvendiggjør seponering hos 10-20 %. Derfor er det viktig med tett klinisk oppfølging og monitorering av blodprøver (hematologi, lever, amylase). Azatioprin bør ikke brukes av pasienter over 60-65 år på grunn av økt risiko for å utvikle lymfoproliferativ sykdom. MTX har en sterkere antiinflammatorisk effekt enn azatioprin, og en noe svakere immunsuppressiv virkning. Metotreksat er embryotoksisk og må under ingen omstendigheter brukes av gravide eller kvinner som planlegger graviditet. Både menn og kvinner som står på metotreksat bør ha stoppet behandlingen minst 3 måneder før.
De fleste medikamentene nevnt over kan gi bedring av symptomer og dempe betennelsen, men griper ikke inn i den underliggende sykdomsårsaken. Biologiske medisiner har vært i bruk som behandling av pasienter med IBD i snart 20 år, og viser seg å ha potensiale til å bedre sykdomsforløpet. Tumornekrosefaktor alfa (TNF-α)-hemmere brukes nå i utstrakt grad hos pasienter med moderat til alvorlig CD og UC. Dette er monoklonale antistoffer som binder seg med høy affinitet til løselig membranassosiert TNF-α og hemmer aktiviteten av TNF-α. De viktigste bivirkningene er hyppigere infeksjoner og infusjonsrelaterte reaksjoner. I Norge er infliksimab (Remicade®, Remsima®, Inflectra®) og adalimumab (Humira®) mest brukt. Disse administreres henholdsvis intravenøst og subcutant. Golimumab (Simponi®) er godkjent til bruk hos pasienter med UC og administreres subcutant. Nylig har vedolizumab (Entyvio®) blitt godkjent til bruk hos pasienter som ikke responderer eller har mistet effekten av TNF-α-hemmere. På grunn av sin tarmspesifisitet har vedolizumab lite bivirkninger sammenlignet med anti-TNF-α(20).
Dessverre er det en del som ikke responderer på biologisk behandling (primær non-responder), mens andre mister effekt over tid pga antistoffer eller av årsaker vi ikke kjenner (sekundær non-responder). Initial respons sees hos i overkant av 2/3 av pasientene, og ca 1/3 går i endoskopisk remisjon. Det anslås at rundt
10 – 12 % stopper behandling eller bytter per år pga tap av effekt eller intoleranse. De til nå godkjente biologiske medisinene er svært dyre og har i løpet av få tiår blitt den største utgiftsposten innen IBD-omsorgen. I 2014 kom det første biotilsvarende infliximab (Remsima®) på markedet i Norge. Med en prisreduksjon på 69 %
sammenlignet med originalpreparatet Remicade®, hadde Remsima® ved utgangen av 2015 nesten overtatt markedet fullstendig. Prisreduksjonen vil trolig endre den kliniske bruken av biologiske medisiner i retning av at flere pasienter får dette, tidligere og i mer tilpassede doser. Man så allerede en klar økning i total bruk av infliksimab i 2015 (21).
For pasienter med CD vil 30 – 50 % trenge IBD-rettet intraabdominal kirurgi ila de første 10 årene med sykdom (13). Sykdom i terminale ileum, strikturerende eller penetrerende sykdom og tidlig sykdomsdebut øker risiko for kirurgi. For UC blir omtrent 10 % kolektomert ila 10 år, med høyest sannsynlighet de første 2 årene etter diagnose (14). Her er totalkolitt og høy alder ved diagnose viktige risikofaktorer.
Inflammatorisk tarmsykdom rammer stadig flere i den vestlige verden. Opp mot halvparten av pasientene får et komplisert sykdomsforløp, og mange vil trenge kraftig antiinflammatorisk behandling eller kirurgi. Uførhet og sykefravær er høyere for pasienter med IBD, men det sees ikke økt dødelighet. Individuell oppfølgning fra diagnosetidspunktet, med vekt på spesielle prognostiske faktorer, kan styre sykdomsforløpet i en mildere retning. Stadig nye behandlingsalternativer (inkludert biologisk behandling) gir flere muligheter for pasienter med alvorlig sykdom, men stiller også økende krav til behandlers kompetanse.
En modifisert utgave av artikkelen trykkes parallelt i Best Practice gastroenterologi, juni 2016.
Referanser