Patologiske leverprøver kan være det eneste tegnet på leversykdom og i visse tilfeller kan selv en liten økning indikere et avansert stadium av leversykdom. Det anbefales derfor at man alltid vurderer utredning av patologiske prøver, uansett nivå eller varighet.
Vi vil i det følgende karakterisere patologiske leverprøver fra to syns-vinkler. En nedenfra-opp strategi vil ta utgangspunkt i de patologiske leverprøvene der vi prøver å tolke hva det biokjemiske utfallet forteller oss. Mens en ovenfra-ned strategi tar utgangspunkt i de vanligst forekommende sykdommene med mønster-gjenkjenning av den biokjemiske profilen og andre kliniske karakteristika som gjenspeiler disse sykdommene. En god diagnostisk evaluering bør involvere begge disse øvelsene. I denne sammenheng vil vi begrense oss til omtale av de vanligst forekommende kroniske leversykdommene, siden disse er vanskeligere å oppdage.
Leveren er det mest metabolsk aktive organ og har høyt uttrykk av organspesifikke gener.1 Herunder inngår produksjon av plasmaproteiner som albumin, flere koagulasjonsfaktorer, lipoproteiner, ceruloplasmin, transferrin og komplementfaktorer. Således er albumin og INR (måler koagulasjonsfaktorene II, V, VII, IX, X) gode markører for leverens syntesefunksjon (tabell 1). Det er imidlertid viktig å være klar over andre årsaker til forstyrrelser i disse markørene; hovedsakelig underernæring eller økt tap via nyrer/tarm ved tolkning av albumin, og mangel på vitamin K eller bruk av vitamin K antagonist ved tolkning av INR. Bilirubin konjugeres i og skilles ut via leveren som følge av nedbrytning av heme fra de røde blodcellene. Lett forhøyet ukonjugert bilirubin kan ses ved hemolyse og ved genetiske defekter i konjugering (Gilberts syndrom). Høye bilirubinverdier ses ved obstuksjon av galleganger. Forhøyede nivåer av bilirubin og/eller INR sekundært til parenkymatøs leversykdom er alvorlige tegn og inngår, sammen med kreatininverdien, i utregningen av MELD (model for end-stage liver disease) skår som prediktor for mortalitet.2, 3 Synteseparameterne albumin, INR og bilirubin inngår også, sammen med klinisk evaluering av encefalopatigrad og ascites, i skåringsverktøyet for Child-Pugh gradering ved cirrhose. Child-Pugh grad A, B og C sier noe om grad av dekompensering ved cirrhose og gjenspeiler dødelighet ved tilstanden.
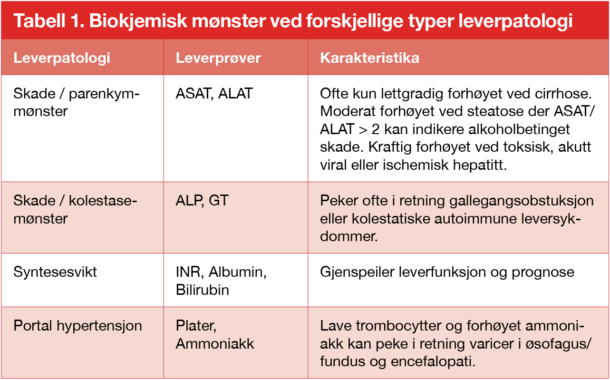
Tabell 1.
Transaminaser kan lekke ut fra levercellene under pågående inflammasjon og er markører for celleskade. Der ALAT (alanin aminotransferase) er leverspesifikt, kan ASAT (aspartat aminotransferase) stamme fra hjertemuskel og skjellettmuskel. Fordelen med å måle begge er at en relativt forhøyet ASAT / ALAT ratio kan peke i retning alkoholisk leversykdom og cirrhose,4, 5 og at ASAT gir bedre dag til dag dynamikk hos inneliggende pasienter grunnet kortere halveringstid.
ALP (alkalisk fosfatase) målt i plasma stammer hovedsakelig fra galle-gangsepitelet i lever og fra skjelett, men kan også være forhøyet ved graviditet (fra placenta). Beinspesifikt ALP kan måles separat der ALP er isolert forhøyet, f.eks. hos unge i vekst og ved patologiske prosesser i bein (f.eks. vitamin D-mangel og metastaser). Isolert forhøyet ALP forekommer der gamma-glutamyltransferase (GT) ikke er samtidig forhøyet. GT finnes i rikelige mengder i lever, men også i flere andre organer bortsett fra i skjelett. ALP og GT, som også kalles kolestasemarkører, kan indikerer inflammasjon eller obstruksjon i galleganger. I slike tilfeller er ofte disse markørene uforholdsvis høyere enn transaminaseneøkningen, angitt som antall ganger økning i forhold til øvre referansegrense (x ULN – upper limit normal). I en slik situasjon vil graden av bilirubin-stigning gi en indikasjon på grad av patologi.
Ferritin kan også plasseres i kategorien for skade-markør der en isolert forhøyelse bør ses i sammenheng med transferrin metning. Se egen artikkel om ferritin i dette nummeret.
Ved portal hypertensjon foreligger en forhøyet trykkgradient mellom portvene- og levervene-systemet. Tilstanden forårsakes vanligvis av cirrhose, men det fins også andre årsaker. Trombocytopeni predikerer portal hypertensjon med gastroøsofagale varicer. Legger man til splenomegali som variabel, økes sensitiviteten betraktelig (fra 0.71 til 0.93).6 Antagelig er det flere andre faktorer, som lavt trombopoietin og benmargssuppresjon, som også bidrar til lave platetall (ved siden av hypersplenisme) ved portal hypertensjon.7 Videre er forhøyet ammoniakk en kjent prediktor for en annen komplikasjon til portal hypertensjon, nemlig hepatisk encefalopati. Den positive prediktive verdien er imidlertid mye lavere enn den negative prediktive verdien og en korrelasjon til grad av encefalopati er kun til stede ved akutte leversykdommer, ikke kroniske.8
Non-alkoholisk fettleversykdom (NAFLD) er en tilstand som følger overvektsepidemien og vil få store kliniske konsekvenser i fremtiden. Den globale prevalensen ble i en metaanalyse anslått til 25 %.9 Tilstanden vil hos en betydelig andel kunne ledsages av en betennelse, såkalt non-alkoholisk steatohepatitt (NASH) og deretter kunne progrediere til fibrose.9 Grunnet den økende prevalensen regner man med at NASH vil kunne ta over som den viktigste årsaken til levertransplantasjon i USA.10 Utfall i leverprøvene ved NAFLD bør ses i sammenheng med BMI, blodtrykk, HbA1c og blodlipider, siden overvekt, hypertensjon, diabetes og hyperlipidemi er sterkt assosierte tilstander.9 Histologisk eller radiologisk påvist leversteatose, i tillegg til utelukkelse av alkoholoverforbruk, er viktige momenter for å stille diagnosen.11 Uspesifikt lett forhøyede titer på autoantistoffer kan forekomme.12 Grunnet den lave sensitiviteten, anbefales ikke leverprøver tatt rutinemessig for screening av NAFLD hos risikogrupper.11 Ved klinisk mistanke bør man heller benytte validerte scoringssystemer som FIB-4 og NFS (se tabell 2) for å sannsynliggjøre avansert fibrose ved mistenkt NAFLD uavhengig av om leverprøvene er forhøyet, og henvise videre til billeddiagnostikk og elastografi ved forhøyet skår.13

Merknad: BMI, kroppsmasseindeks; DM, forhøyet fastende glukose / diabetes mellitus.
Alkohol har lenge vært kjent for å være toksisk for leveren. Det histologiske bildet ved alkoholindusert leverskade likner NAFLD med få unntak.14 Anamnestisk inntak av mer enn to alkoholenheter (à 15 ml ren alkohol) for kvinner og tre enheter for menn over lengre tid kombinert med leversteatose er det viktigste diagnostiske momentet. Der det er mistanke om underrapportert forbruk vil den nye alkoholspesifikke markøren fosfatidyletanol (PEth) kunne brukes til å påvise skadelig inntak av alkohol.15
Typiske kjennetegn på alkohol-indusert leversykdom er en ASAT/ALAT ratio over 2 kombinert med en GT på minst to ganger øvre referansegrense.5 Det kan foreligge en makrocytose av røde blodlegemer. Transaminasene overstiger sjelden verdier rundt 300, gitt at det ikke er andre mekanismer for leverskade i tillegg.5 En forhøyet ASAT/ALAT ratio ved cirrhose regnes som en uavhengig prediktor for død, men ikke hvis leverskaden er alkohol-indusert.4
De viktigste årsakene til kronisk viral hepatitt er hepatitt B og C. Disse kan enkelt påvises ved taking av henholdsvis HbsAg og anti-HCV antistoff. Prevalensen er spesielt høy hos innvandrere fra Asia og Afrika sør for Sahara, injiserende rusmisbrukere og menn som har sex med menn. Diagnosen er viktig å stille fordi behandlingsutsiktene nå er svært gode.
Autoimmun leversykdom er den vanligste årsaken til levertransplantasjon og innbefatter autoimmun hepatitt (AIH), primær biliær cholangitt (PBC) og primær skleroserende cholangitt (PSC). Slik navnene tilsier, er det ved den førstnevnte formen primært forhøyede transaminaser, mens man ved de to neste primært ser et kolestasemønster med forhøyede ALP og GT, samt bilirubin i varierende grad. Viktig for karakteristikken av disse tilstandene er anti mitokondrie antistoff (AMA – spesifikt for PBC),
anti glattmuskel antistoff (ASMA – spesifikt for AIH) og anti nukleært antistoff (ANA – støtter AIH-dia-gnosen) samt immunglobuliner (der IgM er forhøyet ved PBC og IgG ved AIH).
En viktig differensialdiagnose ved forhøyede leverprøver er jernavleiringssykdom, også kalt hemokroma-tose. Denne sykdommen belyses nærmere i en annen artikkel i denne utgaven av indremedisineren. Den viktigste indikatoren for denne tilstanden er forhøyet transferrin metning.16 Diagnosen stilles ved en gentest.
De britiske retningslinjene for vurderingen av patologiske leverprøver ble nylig revidert.13 Vi har prøvd å gjengi noen av disse anbefalingene i en forenklet form i tabell 3. Som vist i de to første kolonnene i tabell 3, anbefales det en standardpakke med basisblodprøver og deretter tilleggsprøver inkludert ultralyd abdomen ved tegn til patologi i basisprøvene. I den samme tabellen har vi i den tredje kolonnen samlet forslag til andre prøver som også kan være nyttige i utredningen av spesielle problemstillinger. De internasjonale retningslinjene understreker videre viktigheten av å vurdere patologiske leverprøver i lys av tidligere resultater (kurve-funksjon i DIPS). Som nevnt i ingressen over er det viktig å ha i mente at graden av patologi på prøveresultat ikke nødvendigvis trenger å gjenspeile graden av leverskade. Utredning av årsak til patologiske leverprøver anbefales vurdert utført uansett nivå eller varighet.
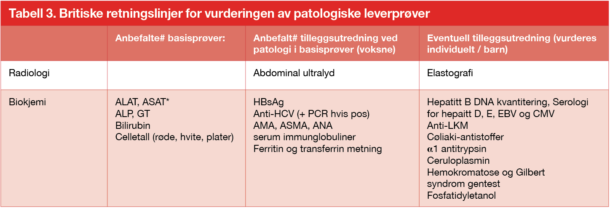
Merknad: HBsAg, Hepatitt B overflateantigen; Anti-HCV, Anti-hepatitt C antistoff; AMA, anti-mitokondrie antistoff; ASMA, anti-glattmuskel antistoff; ANA, anti-nukleært antistoff; EBV, epstein-bar virus; CMV, cytomegalusvirus. Anti-LKM, anti-lever-nyre microsom antistoff.
#Anbefaling i henhold til britiske retningslinjer (se referanse13)
*Inngår ikke i anbefalinger men kan gi nyttig tilleggsinformasjon, f.eks. som ledd i NAFLD risikoskår.
Referanser