SGLT2-hemmere (sodium glucose cotransporter 2 inhibitors) kom på markedet i Norge i 2012 for behandling av diabetes type 2 (Tabell 1). Blodsukkersenkende effekt kombinert med reduksjon i forekomst av kardiovaskulære hendelser og nyresvikt har gitt medikamentgruppen et bredt bruksområde. Imidlertid er alvorlige ketoacidoser, ofte med nær normalt blodsukker, en livstruende komplikasjon som maner til forsiktighet.

Ingrid Nermoen, overlege og førsteamanuensis, PhD, Endokrinologisk avdeling Akershus universitetssykehus og Institutt for klinisk medisin, Campus Ahus, Universitetet i Oslo
Archana Sharma, overlege og phd -kandidat, Endokrinologisk avdeling Akershus universitetssykehus
Kristine Vaage Hatlen, overlege og phd-kandidat, Institutt for klinisk medisin, Campus Ahus, Universitetet i Oslo
En 62 år gammel mann med hypertensjon og kjent diabetes type 2 siste 13 år ble akutt innlagt ved medisinsk avdeling. Han hadde periodevis vært sykmeldt siste tre måneder grunnet slitenhet og vanskelig regulerbart blodsukker. De siste to dagene før innleggelsen hadde han tannverk og ble innlagt med nedsatt allmenntilstand og oppkast. Han brukte følgende diabetesmedikamenter: Trajenta® (DDP-4 hemmer) 5 mg x 1 og Xigduo® [SGLT2-hemmer (dapagliflozin) og metformin] 5/1000 mg x 1. Ved innkomst var han medtatt, afebril, men klar og orientert med puls 98/min, respirasjonsfrekvens 24/min, SaO2 98%, og blodtrykk 150/70 mmHg. Det var normale funn ved generell organundersøkelse. Laboratorieprøver viste: Arteriell blodgass pH 7,11 (7.35- 7.45), pCO2 1,74 kPa (4,7 – 6), HCO3- 4,0 mmol/L (22-26), laktat 0,8 mol/L (00-2.4), glukose 10,8 mmol/L (ikke fastende bør være under 11.1 mmol/l), leukocytter 10,5 x 109/l (3,5-8,8), C-reaktivt protein 90 mg/L (< 5), urinstix: 3+ ketoner og 4+ glukose, HbA1c 66 mmol/mol (20-42). Normale funn på nyre-/leverprøver og røntgen thorax. Etter utskrivelse kom også svar som var negative med tanke på diabetes type 1: C-peptid 734 pmol/l (300-800) og negative diabetes antistoffer.
Denne kasuistikken er et eksempel på alvorlig euglykemisk ketoacidose hos en pasient med diabetes type 2 med bevart insulinproduksjon og bruk av SGLT2-hemmer. Hadde ikke LIS-lege i akuttmottaket tatt en syre-base-status på denne pasienten, kunne han raskt blitt mye dårligere. Pasienten ble behandlet etter vanlige retningslinjer for diabetes ketoacidose og utskrevet i sin vanlige tilstand med metformin og insulin.
SGLT2 uttrykkes selektivt i proksimale nyretubuli hvor 90 % av glukose og ca. 65% av natrium reabsorberes. Hemming av kanalproteinet medfører glukosuri og natriurese (Figur 1). Blodglukoseverdiene senkes som en konsekvens av den reduserte glukosereabsorpsjonen i en insulin-uavhengig prosess som gir lav risiko for hypoglykemi. Den manglende reabsorpsjonen i proksimale tubuli senses som økt natriumkonsentrasjon av macula densa. Dette hemmer renin- og angiotensinutskillelsen, som resulterer i vasodilatasjon av efferente arteriole, og stimulerer til adenosinutskillelse, som igjen resulterer i vasokonstriksjon av afferente arteriole (1), (Figur 1). Denne reduksjonen av den glomerulære filtrasjonsraten gir en renoprotektiv effekt. Den kardiovaskulære effekten er basert på blant annet en fordelaktig hemodynamisk- og metabolsk effekt, i tillegg til en gunstig nervemediert effekt (2).
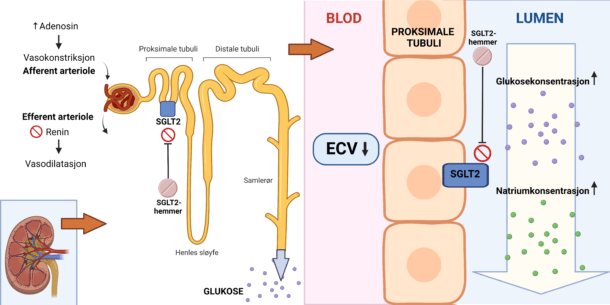
I 2008 kom det i retningslinjer fra Food and Drug Administration (FDA) at ingen nye diabetesmedikamenter må være assosiert med økt forekomst av kardiovaskulære hendelser. Studiene på SGLT2-hemmere viste til manges overraskelse færre hjerte-/ karhendelser, først i EMPA-REG studien (3). Deretter er den gunstige effekten vist for flere SGLT2-hemmere. Studiene har hatt såkalt 3P-MACE som endepunkt. Dette er et sammensatt endepunkt definert som kardiovaskulær død, ikke fatalt hjerteinfarkt og ikke fatalt cerebralt insult. I tillegg er den reduserte risikoen for hospitalisering grunnet hjertesvikt godt dokumentert (4). Senere studier har vist at utviklingen av kronisk nyresykdom bremses, inklusivt diabetisk nyreskade (4). Ved tolking av resultatene skal man imidlertid være oppmerksom på begrenset generaliserbarhet. I EMPA-REG studien var 70 % menn med gjennomsnittsalder 63 år, og alle hadde hjerte-/karsykdom. En metaanalyse konkluderte med relativ risikoreduksjon i 3P -MACE på 11%. Videre konkluderte metaanalysen med 46 % relativ risikoreduksjon for nyrehendelser (forverrelse av nyrefunksjon, endestadium nyresykdom og nyredød) og 30% reduksjon i hospitalisering for hjertesvikt (4) . Ved diabetes type 2 viste metaanalysen imidlertid kun gunstig effekt hos pasienter som hadde kjent hjerte-/karsykdom, ikke ved multiple risikofaktorer uten etablert hjerte-/karsykdom. Den reduserte frekvensen av hospitalisering for hjertesvikt og redusert forekomst av nyrehendelser var like god i gruppene med og uten etablert hjerte-/karsykdom. Med tanke på generaliserbarhet, er det også viktig å få frem at ertugliflozin ikke ser ut til å ha samme gunstige effekt på kardiovaskulære endepunkter.
Senere studier på empagliflozin og dapagliflozin har også vist gunstig effekt på kardiovaskulære hendelser hos pasienter med hjertesvikt uten diabetes, uavhengig av ejeksjonsfraksjon (3, 5). Fra 2021 anbefalte europeiske retningslinjer SGLT2-hemmere som et medikament for behandling av hjertesvikt sammen med angiotensinkonverterende enzym-hemmer, angiotensin reseptorblokker, angiotensinreseptor- neprilysin-inhibitor, mineralkortikoidantagonist og betablokkere (6). Dette har medført at kardiologer også har begynt å foreskrive SGLT2-hemmere. Tilsvarende gjelder nefrologer grunnet gunstige nyreutfall.
Det er klare anbefalinger for kolesterolsenkende behandling som primærprofylakse ved diabetes, men vi har ikke kommet så langt at SGLT2-hemmere brukes som primærprofylakse for hjerte-/ karsykdom eller nyresykdom ved diabetes type 2 ennå i Norge. I nye amerikanske og europeiske retningslinjer er imidlertid dette anbefalt vurdert til høyrisikopasienter (7).
En hyppig bivirkning av SGLT2-hemmere er urinveisinfeksjon (UVI) – i en metaanalyse var forekomst av UVI 8.0% vs. 2.1% i kontrollgruppen med en odds ratio på 1.34 (8). Genital candidainfeksjon er rapportert med mer enn tre ganger økt risiko (odds ratio 3.5) og hos opptil 10-15 % av kvinner (8). Vær oppmerksom på at menn også kan få genitale infeksjoner.
Hypotensjon kan forekomme da pasientene kan være dehydrerte, og er spesielt viktig hos eldre med flere medikamenter (8). Det er sett økt forekomst av fotamputasjoner, særlig ved bruk av kanagliflozin – en studie viste en dobling, 6.3 vs. 3.4 per 1000 pasientår (9). En annen sjelden, men alvorlig bivirkning, er nekrotiserende fasciitt i perineum (Fournier`s gangren).
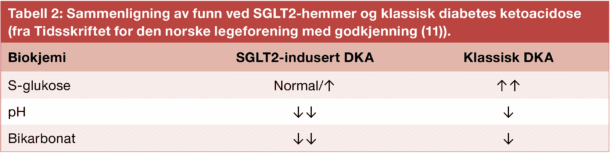
SGLT2-hemmere er assosiert med økt forekomst av diabetes ketoacidose (DKA) og spesielt euglykemisk DKA. En populasjonsbasert studie med > 350 000 deltakere viste økt risiko for DKA ved bruk av SGLT2-hemmere sammenlignet med DPP4-hemmere, med incidensrate 2.03 vs. 0.75 per 1000 personår (10). Det kan være flere mekanismer som bidrar til dette: Lavere blodglukose grunnet glukosuri medfører lavere insulinnivå med økt lipolyse og økt ketonlegemeproduksjon. I nyrene økes reabsorbsjonen av ketonlegemer. SGLT2-hemmere stimulerer glukagonproduksjon, som øker hepatisk glukose-produksjon, og økt dannelse av ketonlegemer via økt fettsyreforbrenning. Ved en SGLT2-hemmer-indusert DKA kan vi derfor se meget lav bikarbonat (Tabell 2), i tillegg til både euglykemisk- og hyperglykemisk ketoacidose (Figur 2). Euglykemien kan medføre forsinkelse i diagnosen.
![Figur 2: Mekanismer for diabetes ketoacidose ved SGLT2-hemmere [Fra Tidsskriftet for den norske legeforening, trykkes med godkjenning (11)].](https://indremedisineren.no/wp-content/uploads/2022/12/Nermoen.-Figur-2_mek.-for-ketoacidose.-1-610x289.jpg)
Allerede i 2015 kom det en advarsel om DKA fra States Legemiddelverk og FDA, og det ble rapportert fatale hendelser ved bruk av SGLT2-hemmere. Samtidig ble det observert økt forekomst av DKA hos pasienter med diabetes type 2 på AHUS. Før hadde vi registrert gjennomsnittlig 1-2 pasienter i året, mot 7-8 tilfeller per år i perioden 2017-2018. Vi registrerte da alle tilfellene i ett år, og fant flere med alvorlig ketoacidose (11). Erfaringen var at det oftest var en disponerende faktor for DKA til stede, i tillegg til inntak av SGLT2-hemmer. Blant de identifiserte risikofaktorene var kosthold med lavt karbohydratinnhold, alkohol, infeksjon, ikke oppdaget kreft, glukokortikoidbehandling eller udiagnostisert autoimmun diabetes. Vi kontaktet RELIS og meldte alle tilfellene. I 2018 hadde RELIS fått innmeldt 30 tilfeller, og per okt. 2022 var det innmeldt 118 tilfeller med ketoacidose/DKA/euglykemisk DKA assosiert med bruk av SGLT2-hemmere (personlig meddelelse). Vi oppfordrer kolleger til å melde inn mistenkte legemiddelbivirkninger for økt kunnskap om legemidlers sikkerhet. https://relis.no/meldeskjema/
SGLT2-hemmere var også registrert for bruk ved diabetes type 1, men indikasjonen ble fjernet grunnet økt risiko for DKA. Metformin er fremdeles førstevalg ved diabetes type 2 i Norge, men det jobbes kontinuerlig med revidering av retningslinjene (12). SGLT2-hemmere kan vurderes når pasienten ikke oppnår glykemisk mål med metformin og livsstilsråd særlig ved
Den glukosesenkende effekten av SGLT2-hemmere er redusert ved nyresvikt. SGLT2-hemmere er derfor ikke anbefalt i behandlingen av diabetes type 2 ved GFR <30 mL/min/1,73m2. Ved hjertesvikt uten diabetes type 2 brukes SGLT2-hemmere ned til GFR > 20 mL/min/1,73m2. Når SGLT2-hemmer initieres primært grunnet nyresvikt, hjertesvikt eller kardiovaskulær sykdom hos pasienter med diabetes type 2, er det viktig å være oppmerksom på den begrensede blodsukkerreduserende effekten medikamentet har, slik at ikke for mye øvrig diabetesbehandling seponeres samtidig. Pasientene kan da få dårligere diabetesregulering med hyperglykemiske symptomer. Seponering eller kraftig reduksjon av insulindoser samtidig med oppstart av SGLT2-hemmer disponerer for ketoacidose. Det er viktig at pasient og behandler er klar over denne risikoen, og pasienten må gjøres oppmerksom på eventuelle symptomer på DKA.
Det jobbes med revidering av norske anbefalinger vedrørende SGLT2-hemmere og diabetes type 2, som vil være veiledende når de kommer. Vi, med flere (13), anbefaler inntil videre ikke å starte med SGLT2-hemmere til pasienter med diabetes type 2 som har følgende tilstander:
Grunnet bivirkninger nevnt over anbefales følgende tiltak [se også norsk veileder i endokrinologi (14) og amerikanske- og europeiske retningslinjer (15)]:
Dersom pasienten skal opereres eller har fastet, og ikke har pauset SGLT2-hemmer som planlagt, kan kapillær eller venøst keton (β-hydroksybutyrat) og venøs eller arteriell blodgass måles.
β-hydroksybutyrat er det ketonet som det produseres mest av i starten av en DKA. De fleste laboratorier tilbyr ikke denne analysen, men da kan β-hydroksybutyrat måles kapillært. Alle akuttmottak anbefales å ha slike strimler tilgjengelig for å kunne fange opp DKA tidlig i forløpet. Anestesiavdelinger anbefales å ha prosedyrer om SGLT2-hemmere ved diabetes og operasjoner. Ketonene man måler ved urinstix er for det meste acetoacetat og kan derfor være negativ i starten av en DKA. Tolkning av β-hydroksybutyrat fremgår av tabell 3.

Kasuistikken innledningsvis illustrerer viktigheten av å alltid tenke på ketoacidose hos en dårlig pasient med diabetes, og ha lav terskel for å måle syre-basestatus i akuttmottaket slik at DKA ikke oversees. Hvis pasienten står på en SGLT2-hemmer, ta syre-base status og tenk på euglykemisk DKA. For å fange opp en begynnende ketoacidose anbefales kapillær β-hydroxybutyrat (16).
Vær også oppmerksom på at pasienten kan ha en udiagnostisert autoimmun diabetes. Disse skal ikke ha SGLT2-hemmer. Anti-GAD og C-peptid brukes diagnostisk ved mistanke om autoimmun diabetes. DKA skal behandles etter vanlige retningslinjer uavhengig om det er en euglykemisk eller hyperglykemisk DKA.
Husk:
