Streptococcus pyogenes forårsaker et bredt spekter av sykdomsmanifestasjoner, hvorav nekrotiserende bløtvevsinfeksjon er den mest fryktede. En sterk økning i antall alvorlige S. pyogenes-infeksjoner har blitt rapportert fra hele Europa siste året, men hva ligger bak dette oppsvinget? Og hvordan er situasjonen i Norge?
Oddvar Oppegaard, overlege dr.med., Infeksjonsavdelingen, Haukeland universitetssykehus og Universitetet i Bergen.
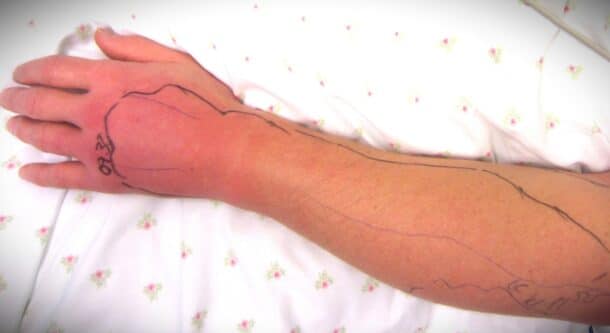
Infeksjoner forårsaket av Streptococcus pyogenes (ofte omtalt som gruppe A streptokokk) er relativt vanlig i de fleste samfunn. Tonsillitt, peritonsillær abscess og post-partum feber ble beskrevet allerede i den 2500 år gamle medisinske læreboken Corpus Hippocraticum, og indikerer at vi har hatt en langvarig sameksistens med denne mikroben (1).
S. pyogenes utviser dog varierende grad av patogenisitet. Asymptomatisk bærerskap i halsen er tross alt den vanligste formen for sameksistens, og forekommer hos 10 – 20 % av barn i skolealder og blant 1 – 5 % av friske voksne (2). En del utvikler imidlertid symptomatisk infeksjon, hovedsakelig i form av tonsillitt, otitt eller impetigo (3). Tidvis sirkulerer også stammer som gir opphav til skarlagensfeber.
Langt sjeldnere utvikles mer alvorlige tilstander som medfører sykehusinnleggelse, herunder erysipelas (ca. 25 %), luftveisinfeksjoner (ca. 15 %), postpartum infeksjoner (ca. 10 %), eller bein- og leddinfeksjoner (ca. 10 %) (4). Nekrotiserende bløtvevsinfeksjoner er kanskje den mest dramatiske presentasjonsformen, og utgjør i Norge ca. 5 – 20 % av invasive S. pyogenes-infeksjoner (4, 5). Denne tilstanden har en dødelighet på 10 – 20 % selv ved moderne behandlingsmuligheter, og ytterligere 10 – 20 % gjennomgår amputasjon i kurativ intensjon (6, 7).
Til forskjell fra mange andre bakterielle species, kan S. pyogenes forårsake alvorlig invasiv sykdom hos tilsynelatende friske individer, inkludert barn og gravide (8). Globalt er det estimert at S. pyogenes forårsaker en halv million dødsfall årlig, og en stor andel av disse hos yngre individer (3). God kunnskap om epidemiologi, diagnostikk og behandling er viktig for å bedre prognosen ved S. pyogenes infeksjoner.
Transmisjon av S. pyogenes foregår hovedsakelig ved dråpe- og kontaktsmitte, og epidemiologisk overvåkning utbrudd i skoleklasser har dokumentert kolonisering av opptil 50 % av elevene i løpet av et par uker (9). Tilsvarende transmisjonsrater og utbrudd har vært beskrevet i en rekke militærleirer (10). Trangboddhet og sosial interaksjon er tilsynelatende sterke drivkrefter for spredning av mikroben. Dette understøttes også av at S. pyogenes, i likhet med de fleste luftveisvirus, har en tydelig sesongvariasjon med en topp i det kalde vinterhalvåret (5). Enkelte mener sågar at det foreligger en synergisme mellom virale luftveisagens og S. pyogenes, og at både ko-smitte og ko-infeksjon påvirker sykdomsforekomsten (11).
I enkelte år har det dessuten vært observert en kraftig stigning i antall sykdomstilfeller. Slike utbrudd relateres ofte til spredning av nye genetiske varianter av S. pyogenes som omgår flokkimmuniteten i vertspopulasjonen (12). Etter hvert som befolkningen eksponeres for en slik ny variant vil flokkimmuniteten gradvis øke, og disse utbruddene klinger gjerne av i løpet av et par år.
Forekomsten av S. pyogenes infeksjoner i samfunnet fluktuerer således kontinuerlig, basert på samspillet mellom evolusjon i mikroben, potensiale for smittespredning og immuniteten i befolkningen.
Våren 2023 kom det flere presseoppslag om en overhyppighet av streptokokk-relaterte nekrotiserende bløtvevsinfeksjoner i Stavanger-regionen, inkludert enkelttilfeller med fatalt utkomme. Men Stavanger-regionen var ikke unike i så måte. Allerede høsten 2022 kom de første rapportene fra kontinentet om økt forekomst av alvorlige S. pyogenes-infeksjoner, inkludert nekrotiserende bløtvevsinfeksjoner (13). Tilsvarende observasjoner har senere blitt bekreftet fra de fleste land i Europa, og nasjonale tall fra MSIS viser en tydelig overhyppighet av alvorlige S. pyogenes-infeksjoner i 2023 sammenliknet med foregående år, jf. figur 2 (5, 14, 15, 16).
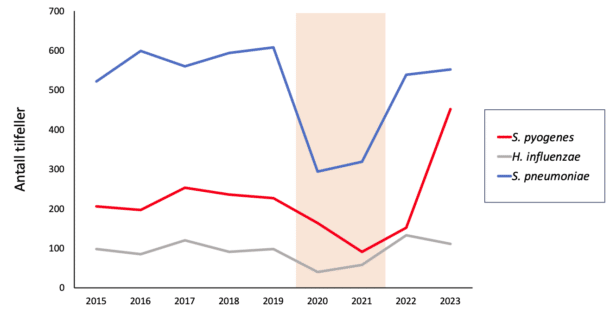
Estimering av forekomst basert på rapportering fra klinikere, som ved MSIS, er sårbart for rapporteringsbias. Med økt fokus og oppmerksomhet rundt tilstanden vil flere klinikere tendere til å rapportere nye tilfeller. Men er den observerte S. pyogenes-epidemien bare en storm i et vannglass? I Danmark er det etablert en felles nasjonal database for alle dyrkningspositive prøver ved landets mikrobiologiske avdelinger. Der finner de en klar økning i antall dyrkningspositive invasive S. pyogenes tilfeller (vekst i blodkultur, spinalvæske eller annen steril lokalisasjon), men også i antallet non-invasive tilfeller (14). Økningen synes således å være reell.
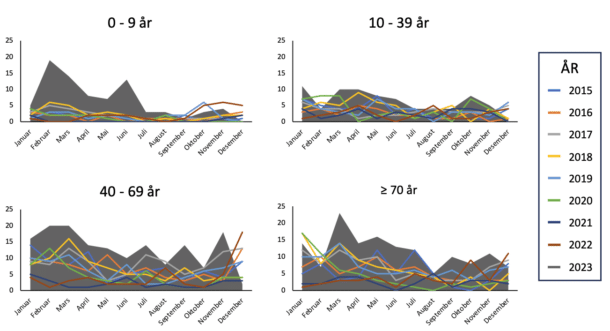
Noe overraskende er økningen av invasive S. pyogenes tilfeller mest uttalt blant de minste barna. I Nederland fant man 42 tilfeller av nekrotiserende bløtvevsinfeksjoner og/eller streptokokk toksisk sjokk-syndrom blant barn < 5 år i 2022, mot normalt 5 – 10 tilfeller per år (13). I Skottland observerte man en dobling av antall tilfeller av empyem forårsaket av S. pyogenes blant barn (15). Også her til lands er det de yngste som står for den mest markante økningen av S. pyogenes-infeksjoner, jf. figur 3.
Hvorfor ble det slik?
Årsaken er sannsynligvis, som alltid, multifaktoriell.
Mye kan diskuteres om de enkelte smitteverntiltakenes treffsikkerhet under Covid-19-pandemien, men det er ikke tvil om at de samlet sett reduserte transmisjonen av Sars-CoV-2-viruset. En bivirkning av smitteverntiltakene var en kraftig reduksjon også i smittespredning av mange andre luftveispatogener, inkludert Haemophilus influenzae, Streptococcus pneumoniae og S. pyogenes, jf. figur 2.
Tall fra Centers for Disease Control and Prevention (CDC) i USA viser at den største nedgangen i antall invasive S. pyogenes infeksjoner under pandemien ble observert nettopp hos de yngste, med opptil 80 % lavere forekomst enn forventet i 2020 (17). Men sparte vi oss for disse infeksjonene, eller bare utsatte vi dem?
Enkelte mener Covid-19-pandemiens smitteverntiltak satte oss i en immunologisk gjeld (18). Når transmisjonen av S. pyogenes ble redusert var det mange barn som ble snytt for sitt første møte med mikroben, noe som trolig påvirket den generelle immuniteten i denne aldersgruppen. Når restriksjonene senere ble opphevet var antallet immunologisk naive barn langt høyere enn i et normalår. Sammenholdt med den utbredte transmisjonen vi vet kan forkomme i denne populasjonen, kan man se for seg at dette kan ha bidratt til en slags bumerang-effekt i forekomsten av S. pyogenes-infeksjoner.
Men hvorfor ser vi ikke en tilsvarende rekyl i forekomsten av H. influenzae og S. pneumoniae, jf. figur 2? De synes kun å ha returnert til sin vanlige forekomst uten noen overhyppighet. Vi er igjen overlatt til spekulasjoner. Kanskje har det virket forebyggende at disse luftveispatogenene inngår i barnevaksinasjonsprogrammet, og at barnepopulasjonen således ikke var immunologisk naive på samme måte.
Forekomsten av flere luftveisvirus har vært redusert under pandemien, og kan potensielt komme tilbake med økt styrke i post-pandemisk fase. Enkelte har tatt til orde for at den observerte økningen i S. pyogenes-infeksjoner til dels kan skyldes en synergistisk effekt med økt forekomst av virale luftveisinfeksjoner.
I en studie fra Frankrike fant de at 60 % av barn med invasive S. pyogenes infeksjoner, hadde fått påvist ko-infeksjon med et luftveisvirus ved ankomst sykehus, inkludert 24 av 24 barn med empyem (16). Tilsvarende funn ble rapportert fra Skottland (15). Ingen av disse studiene var imidlertid designet for å vurdere kausalitet, og betydningen av disse funnene er således usikre. Det er heller ikke dokumentert en relasjon til spesifikke virus, snarere en samvariasjon med diverse luftveisvirus.
Like før covid-19-pandemien brøt ut, ble en ny virulent S. pyogenes variant (M1UK) påvist i Storbritannia (19). M1UK hadde økt produksjon av toksiner, og var assosiert med utbrudd av skarlagensfeber. Spredning til flere land ble påvist, men den fikk sin seiersgang avbrutt av pandemiske smitteverntiltak.
Genetisk karakterisering av invasive S. pyogenes-stammer i post-pandemisk fase har ikke gitt entydige holdepunkter for at den økte forekomsten av invasive infeksjoner skyldes et klonalt utbrudd av en ny og virulent stamme (13, 14, 16). Hovedtyngden av infeksjonene i mange regioner forårsakes likevel av M1UK-stammer. I en studie av alvorlige S. pyogenes lungeinfeksjoner i Skottland ble det dokumentert at 95 % av tilfellene var forårsaket av M1UK (15). Det er derfor ikke usannsynlig at manglende flokkimmunitet mot denne relativt nye genetiske varianten kan ha bidratt til å potensere den pågående S. pyogenes epidemien.
Den epidemiologiske balansen mellom mikrobiell evolusjon og flokkimmunitet vil etter all sannsynlighet snart gjenvinne ekvilibrium for S. pyogenes, og høstens tall fra MSIS indikerer nettopp en slik utvikling (5). Utbruddet understreker dog nytten av epidemiologisk årvåkenhet og internasjonalt samarbeid. Nedbyggingen av FHIs kapasitet til genetisk karakterisering av sirkulerende invasive S. pyogenes-stammer er i så måte et steg i feil retning, og vil vanskeliggjøre fortolkning av den epidemiologiske situasjonen.
Barnepopulasjonen synes å utgjøre den epidemiologiske motoren i S. pyogenes transmisjon, og de rammes også av alvorlige sykdomsmanifestasjoner. Utvikling av vaksiner for pneumokokker og Haemophilus influenzae har hatt betydelig suksess når det gjelder reduksjon av invasiv sykdom hos barn, i tillegg til en sekundær gevinst blant eldre. En S. pyogenes-vaksine ville således være et svært nyttig forebyggende tiltak, spesielt i et internasjonalt perspektiv. Slike vaksiner har vært under utvikling i mer enn 20 år, men har fortsatt ikke nådd fase 3 for kliniske utprøvingsstudier. Veien frem synes derfor fortsatt lang.
Det aktuelle utbruddet synliggjør også viktigheten av å ha god beredskap for diagnostikk og behandling av de mest alvorlige sykdomsmanifestasjonene forårsaket av S. pyogenes, kanskje spesielt nekrotiserende bløtvevsinfeksjoner. Slike infeksjoner er sjeldne, men rask og riktig behandling er avgjørende for pasientens utkomme. Selv med optimal antibakteriell og kirurgisk behandling er mortalitet og morbiditet fremdeles høy. Det er således et stort behov for kliniske studier på nye behandlingsmodaliteter for nekrotiserende bløtvevsinfeksjoner. Nylig viste dog en randomisert studie at immunmodulerende behandling med CD28-hemmeren Reltecimod kortet ned tid til klinisk bedring (20). Kanskje er tiden kommet for utvikling av en enda mer persontilpasset behandlingsstrategi for denne pasientkohorten?
Det pågår allerede norske initiativ til utvikling av randomiserte behandlingsstudier med immunblokkere ved nekrotiserende bløtdelsinfeksjon forårsaket av S. pyogenes (permedinfect.com). Antall tilfeller per behandlingssenter er imidlertid lavt, og skal vi få dette til er vi avhengige av omfattende samarbeid nasjonalt.
Uansett er én ting sikkert – bumerangen S. pyogenes kommer alltid tilbake.