Av Hege Ihle-Hansen, overlege Ph.d, Bærum Sykehus
Sekundærprofylakse er behandling som gis for å forebygge nye hjerneslag og andre vaskulære hendelser. Valg av forebyggende behandling baseres på kunnskap om risikofaktorer, etiologisk mekanisme, effekt av forebyggende tiltak og forventet prognose. Behandlingen må skjønnsmessig individualiseres basert på balanse mellom indikasjoner, kontraindikasjoner og potensiell nytte for den enkelte.
Pasienter med gjennomgått hjerneslag og TIA har økt risiko for ny cerebral hendelse. Nær 25 % av alle hjerneslag er residivslag. Utredning, fortrinnsvis med MR-caput, kartlegging av karrisiko og igangsetting av forebyggende behandling anbefales utført på samme måte ved TIA og hjerneslag. Målet med forebyggende behandling er å hindre både nye slag og andre vaskulære hendelser. Gjennom sykehistorie, klinisk presentasjon og hjerneavbildning, i tillegg til blodprøver og målrettede undersøkelser for eventuelle karotisstenoser og kardiale embolikilder, kan man ofte finne den sannsynlige årsaken til hjerneslaget. Dette gir grunnlaget for den forebyggende behandlingen. I Nasjonale retningslinjer for hjerneslag fra 2010 er kunnskapsgrunnlaget for anbefalt utredning og forebyggende tiltak grundig gjennomgått (Tabell 1) (1).
Ved funn av stumme hjerneinfarkter bør man også vurdere forebyggende tiltak, fordi dette sier noe om grad av karpatologi, men særlig fordi kognitiv svikt oftere utvikles ved gjentatte cerebrale hendelser og kronisk karsykdom (2,3).
Nær halvparten av hjerneslagene kan forbygges gjennom god kontroll av modifiserbare risikofaktorer og livsstilsintervensjon (4). Gode råd for egen helseinnsats er en viktig del av sekundærprofylaksen. Høyrisikofaktorer er atrieflimmer og symptomgivende karotisstenose. Modifiserbare risikofaktorer er høyt blodtrykk, røyking, fysisk inaktivitet, overvekt, abdominal fedme, diabetes, høyt kolesterol, høyt alkoholkonsum, ugunstig kosthold, depresjoner og stress. (1, 5, 6). Tilstedeværelse av flere risikofaktorer er assosiert med høyere mortalitet (7, 8).
For optimal forebyggende behandling må man vite den etiologiske mekanismen til hjerneslaget, vurdere den totale risikofaktorprofilen og vite noe om antatt prognose. Hos pasienter med lang forventet levetid er aggressiv kontroll av alle risikofaktorer anbefalt (7). Både medikamentelle intervensjoner og livsstilsendringer krever individualisert motivasjon og oppfølging over tid. Det bør tidlig avklares hvordan denne oppfølgingen skal ivaretas og justeres ut fra oppnådde behandlingsmål.
Den relative risikoreduksjonen ved forebyggende tiltak kjenner vi fra populasjonsstudier, så vurderingen av potensiell nytte for enkeltindivider vil være skjønnsbasert. Ved skrøpelighet, multisykelighet og kortere forventet levealder bør gevinst av forebyggende tiltak vurderes opp mot bivirkninger og komplikasjoner. Ved kort antatt forventet levetid er forebyggende behandling sjeldent indisert (9).
Platehemmer skal gis etter hjerneinfarkt der det ikke er kardioembolisk kilde med indikasjon for antikoagulasjon (10). Acetylsalisylsyre (ASA) (Albyl-E®) 75 mg og klopidogrel (Plavix®) 75 mg ansees likeverdige (6). ASA dose høyere enn 75 mg gir ikke bedre beskyttelse, men høyere risiko. Kombinasjonen ASA og dipyridamol (Persantin Retard®) har i enkelte studier viste noe bedre forebyggende effekt, men gir ofte hodepine og er ikke anbefalt som førstevalg for alle slagpasienter (11). Ved behandlingsforsøk med denne kombinasjonen anbefales opptrapping av dipyridamol over to uker. Kombinasjonen ASA og klopidorgrel ga ingen økt beskyttelse men økt blødningsrisiko, og anbefales ikke brukt over lang tid (12). Bruk av ASA og klopidogrel i kortere perioder, kan redusere risiko for residiv (13), og brukes i dag i påvente av karotiskirurgi ved høygradig karotisstenose. Hos pasienter som får residiv på ASA, er det vanlig å bytte til klopidogrel. Genotyping for CYP2C19 anbefales i økende grad for å identifisere personer med redusert kapasitet til å danne aktiv klopidogrel-metabolitt (14).
Det er usikkert når oppstart av platehemmer etter hjerneblødning ansees trygt. Bakenforliggende årsak må både representere liten risiko for ny blødning (f.eks. klipset aneurisme, behandlet hypertensjon, medvirkende traume), i tillegg til at indikasjonen for platehemmer må være god (f.eks. akutt hjerteinfarkt, diabetes med komplikasjoner).
Kombinasjonen av platehemmer og antikoagulasjon har uviss effekt, og gir betydelig økt risiko for blødning. Skal kombinasjonen velges, bør det være god indikasjon for begge deler uavhengig av hverandre og dette må veies opp mot risiko. Kombinasjonen platehemmer og de nye direkte antikoagulajonshemmerene (DOAK) anbefales ikke. Det er heller ikke vist sikker tilleggsbeskyttelse ved å legge platehemmer til Marevan ved antatt kardiale embolier der INR har vært i terapeutisk område, men det er praksis i mange miljøer å gjøre dette over en tre måneders periode.
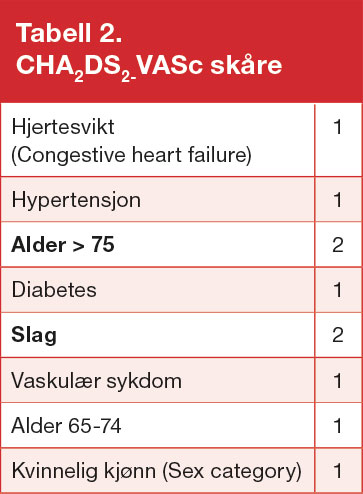 Antikoagulasjon er vanligvis indisert ved kardioembolisk årsak til hjerneinfarkt. Ved akutt hjerteinfarkt med større påvirkning av fremrevegg, redusert EF og risiko for mural trombedannelse, anbefales antikoagulasjon. Pasienter med mekaniske klaffer skal ha antikoagulasjon med Marevan. Ved atrieflimmer reduseres risikoen for iskemiske hjerneslag med rundt 70 % ved bruk av antikoagulasjon, mens ASA gir omtrent 20 % beskyttelse (15). CHA2DS2-VASc-skåre brukes ved atrieflimmer for å identifisere risiko (Tabell 2) (16), og ved skår ≥ 2 anbefales antiokoagulasjonsbehandling. Paroksystisk atrieflimmer antas å gi like stor risiko som permanent atrieflimmer. Det er verdt å merke seg at selv ved vellykket elektrokonvertering eller ablasjon, gjelder CHA2DS2-VASc-skåren for vurdering av risiko.
Antikoagulasjon er vanligvis indisert ved kardioembolisk årsak til hjerneinfarkt. Ved akutt hjerteinfarkt med større påvirkning av fremrevegg, redusert EF og risiko for mural trombedannelse, anbefales antikoagulasjon. Pasienter med mekaniske klaffer skal ha antikoagulasjon med Marevan. Ved atrieflimmer reduseres risikoen for iskemiske hjerneslag med rundt 70 % ved bruk av antikoagulasjon, mens ASA gir omtrent 20 % beskyttelse (15). CHA2DS2-VASc-skåre brukes ved atrieflimmer for å identifisere risiko (Tabell 2) (16), og ved skår ≥ 2 anbefales antiokoagulasjonsbehandling. Paroksystisk atrieflimmer antas å gi like stor risiko som permanent atrieflimmer. Det er verdt å merke seg at selv ved vellykket elektrokonvertering eller ablasjon, gjelder CHA2DS2-VASc-skåren for vurdering av risiko.
Da risikoen for både hjerneslag og atrieflimmer øker med alderen, og eldre oftere får mer alvorlige hjerneslag ved atrieflimmer, er forebyggende slagbehandling viktig også i høy alder. Det er i dag ingen øvre aldersgrense for å anbefale antikoagulasjon, men det utfordrer klinikeren i å identifisere eventuelle kontraindikasjoner (17).
Direkte perorale antikoagulasjonsmidler (DOAK) er dabigatran, apixaban, rivaroksaban og edoxaban. Dabigatran, en oral reversibel trombinhemmer, som reduserer risiko for hjerneslag hos pasienter med atrieflimmer (18). Ved dabigatran dosert 150 mg x 2 oppnås bedre beskyttelse mot cerebrale hendelser sammenlignet med warfarin med samme blødningsrisiko, mens 110 mg x 2 gir lik beskyttelse mot hjerneslag og lavere blødningsrisiko (18). Det har imidlertid betydning hvor godt warfarinbehandlingen er gjennomført.
En norsk Cochraneanalyse viser at bruk av faktor Xa-hemmere (rivaroksaban, apixaban og edoxaban) reduserer antall iskemiske slag signifikant sammenlignet med warfarin hos pasienter med atrieflimmer (19). I tillegg er det noe mindre blødningskomplikasjoner, men her er tallene mindre robuste. Vi har ikke godt nok grunnlag til å gi anbefalinger knyttet til hvilke av faktor Xa-hemmere som gir best forebyggende effekt. Nye nasjonale retningslinjer foreslår nå bruk av DOAK fremfor Marevan hos pasienter med atrieflimmer og tidligere hjerneslag og TIA (20).
Studier av DOAK som forebyggende behandling ved atrieflimmer ,har ikke inkludert pasienter med akutte hjerneslag. Vi mangler derfor data på når det er riktig å initiere DOAK etter et hjerneslag forårsaket av atrieflimmer. Skrøpelige pasienter med kardioembolisk hjerneslag har antatt både høy risiko for blødning i infarktområdet og større sannsynlighet for cerebral angiopati. I påvente av flere studier, antidot og retningslinjer, anbefales oftere Marevan som førstevalg der det er tilleggsindikasjon for ASA, hos skrøpelige pasienter, ved nyresvikt og etter større kardioemboliske slag. Yngre pasienter uten vesentlig andre kompliserende forhold vil kunne få anbefalt oppstart med DOAK rundt 1-2 uker etter slaget, avhengig av risiko for blødning i infarktområdet.
Høyt blodtrykk er definert som et blodtrykk ≥140/90 mmHg, mens et normalt blodtrykk er definert som < 120/80 mmHg (21). Reduksjon i blodtrykk er assosiert med redusert risiko for hjerneslag og residiv slag (22, 23).
Retningslinjene anbefaler en individuell reduksjon på >10/5 mm Hg, snarere enn behandling til under en bestemt grense (6). Ved diabetes anbefales enda strengere kontroll av blodtrykket. Den spreke gamle tåler blodtrykksreduksjon godt og oppnår god forebyggende effekt med hensyn til cerebrale hendelser (24). Hos de med alvorlig grad av karsykdom og hos skrøpelige gamle med svekket kognisjon og funksjon, er imidlertid lavere blodtrykk assosiert med økt dødelighet og flere vaskulære hendelser (25, 26). Disse bør også testes for ortostatisme, og døgnkontinuerlig blodtrykksregistering bør brukes oftere siden døgnvariasjonen ofte er større (27).
Ideell tid for initiering av antihypertensiv medikasjon etter hjerneslag er ikke kjent. Behandling av blodtrykk i akuttfasen er assosiert med ugunstig resultat (28). I klinisk praksis anbefales oppstart tidligst fjerde dag etter hjerneslaget, avhengig av slagets alvorlighetsgrad, prognose og lengde av sykehusoppholdet. Ved påvist forhøyede blodtrykksverdier ved utreise bør det lages en konkret plan for når blodtrykket skal kontrolleres, hva som er grense for oppstart av antihypertensiv behandling og hva som er behandlingsmålet.
Hvilke medikamenter som bør velges og i hvilken dose, vurderes ut ifra tilleggsindikasjon, fare for komplikasjoner og toleranse. Nye norske retningslinjer anbefaler generelt ACE-hemmere, angiotensin II-reseptorantagonister og kalsiumblokkere som førstevalg, der flere medikamenter gjerne kan kombineres (ikke ACE-hemmere og AII-blokkere) (29). Livsstilsintervensjoner anbefalt som ledd i blodtrykkskontroll er vektnedgang, saltrestriksjon, kost rik på frukt og grønt og lite mettet fett, regelmessig fysisk aktivitet og restriksjoner knyttet til alkoholinntak (6).
Symptomgivende karotisstenose over 70 % anbefales operert for å forebygge nye embolier (30, 31), mens ved asymptomatiske stenoser anbefales medikamentell intervensjon (32). Trombenadartektormi anbefales fremfor stent (33). Ved intraarterielle stenoser ser det foreløpig ut til at intensiv medikamentell behandling gir bedre forebyggende effekt (34).
Hva som er optimal behandling ved kryptogene slag (der årsaken ikke identifiseres) og påvist åpenstående foramen ovale (PFO), er omdiskutert. Kirurgisk lukking har ikke vist sikker bedre forebyggende effekt enn platehemmer (35).
Ved hjerneslag teller hvert minutt! Jo tidligere en behandling kan startes, desto mindre blir konsekvensene av hjerneslaget! Trykkes med tillatelse. © Kari C. Toverud CMI (sertifisert medisinsk illustratør).
Framingham-studien viste at en risikofaktor sjelden foreligger alene, og at den enkeltes risiko er knyttet til den totale byrden av risiko (36). Gjennomsnittlig antall risikofaktorer er også vist å øke med pasientens vekt (36).
Kun to studier har vist effekt av statiner i sekundærprofylakse etter hjerneslag, men en gunstig lipidprofil anbefales for å forebygge aterosklerose og andre vaskulære hendelser (37 – 39). I dag anbefales totalkolesterol under 5,0 og en halvering av LDL til verdier ned mot 1,8 – 2,5 mmol/l (6). Behandlingen inkluderer livsstilsendring og kostveiledning. Seponering av statin i akuttfasen av et hjerneslag kan være ugunstig.(40). Eldre og særlig slanke kvinner er mer utsatt for å få statinindusert myopati, så også her kreves godt klinisk skjønn når forebyggende behandling både skal startes og evalueres (41).
Ikke-farmakologisk intervensjon ved modifiserbare risikofaktorer anbefales som ledd i sekundærprofylakse etter cerebrovaskulær sykdom, men styrken i kunnskapsgrunnlaget er lavere (42). Røykekutt anbefales for å forebygge nye cerebrale hendelser. Videre anbefales å tilstrebe en normal vekt med midjemål hos kvinner under 88 cm og hos menn under 102 cm. Hos eldre er imidlertid lav vekt assosiert med økt totalmortalitet, slik at BMI opp mot 28 kg/m2 kan virke gunstig (43). I retningslinjer fra 2006 ble klinikere anbefalt å oppmuntre til vektkontroll gjennom balanse mellom kaloriinntak, fysisk aktivitet og kunnskap om sammenheng (44). Middelhavskost, rik på frukt, grønt, fisk, hele korn, belgfrukter, nøtter og olivenolje med mindre rødt kjøtt, sukker, salt og mettet fett er assosiert med mindre vaskulær sykdom (45, 46). Ekstra tilskudd av omega-3 er ikke vist å forebygge videre karsykdom ved etablert sykdom (47). Diabetes anbefales godt regulert, og hos diabetikere er god blodtrykkskontroll særlig viktig (6). Tilskudd av TrioBe® ved forhøyet homocystein etter hjerneslag er ikke vist å redusere vaskulære hendelser (48). Østrogentilskudd anbefales seponert (6). Enkeltstudier har vist gunstig effekt av kaffe og sjokolade ved hjerneslag (49). Det er konsensus om og ikke å anbefale høyt inntak av alkohol, mens et lavt inntak kan vurderes (44).
Fysisk aktivitet anbefales minst 30 minutter daglig i moderat intensitet (6). Et individualisert treningsprogram kreves ofte ved nevrologiske utfall. Fysisk aktivitet etter hjerneslag er en viktig del av sekundærprofylaksen, men bidrar også i motorisk rehabilitering, kognitiv rehabilitering, som forebygging av depresjon og for å bygge reserver til aldring.
Kronisk stress, både i relasjoner og i arbeid, er en risikofaktor for hjerneslag (5). Opplevelsen av stress hos den enkelte influeres av graden av affekt, egne mestringsstrategier og støtte fra det sosiale nettverket. Det å mestre stress kan påvirke både livet med følgetilstandene etter et hjerneslag og videre forebyggende behandling.
For igangsetting og oppfølging av forebyggende behandling etter hjerneslag, er det viktig med god kartlegging og kunnskap om risikofaktorer, etiologisk mekanisme, preventive tiltak som har vist effekt og forventet prognose. Det krever en god kliniker for å vurdere dette basert på klinisk skjønn til best nytte for den enkelte. Hos yngre anbefales aggressiv kontroll av alle modifiserbare risikofaktorer for å hindre nye slag og død. Hos den skrøpelige er indikasjonene både mindre tydelige og kan oppveies av kontraindikasjoner.